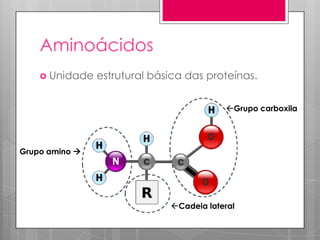
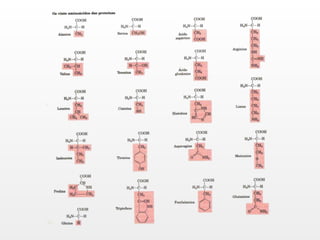
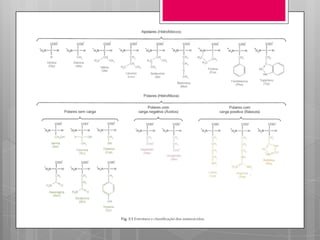
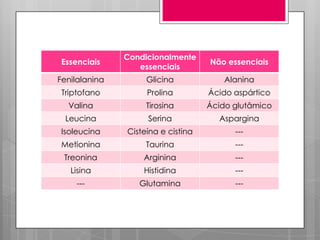
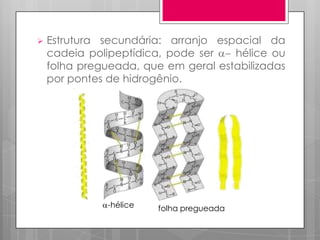
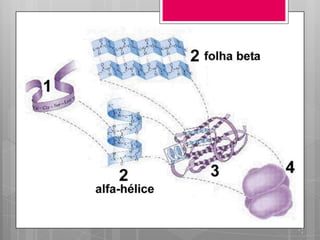
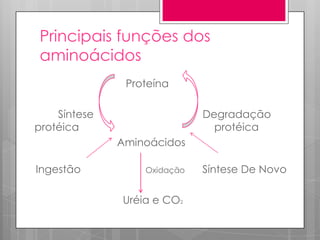
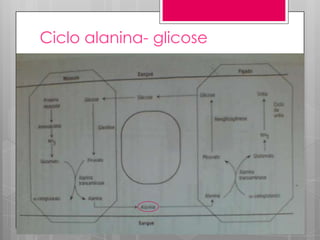
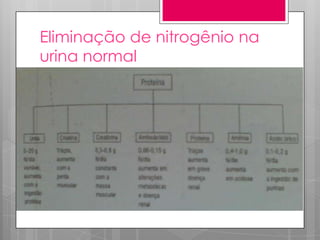
O documento discute a biodisponibilidade de proteínas, incluindo a digestão e absorção de aminoácidos, bem como o metabolismo e funções dos aminoácidos no corpo. Fatores como a estrutura da proteína, fatores antinutricionais e processamento podem afetar a digestibilidade das proteínas. A avaliação da qualidade nutricional das proteínas deve considerar a capacidade de fornecer aminoácidos essenciais.