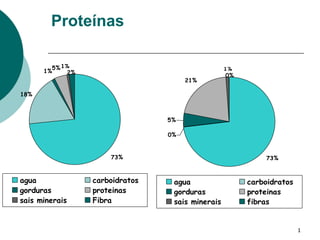
O documento fornece informações sobre proteínas em alimentos. Apresenta gráficos sobre a composição de alimentos como carne, leite e ovos. Detalha as estruturas primária, secundária, terciária e quaternária das proteínas e explica conceitos como aminoácidos, desnaturação e valor biológico.