1) O documento discute concentrações de soluções, incluindo volume de água oxigenada, molalidade e frações molares.
2) É fornecido um exemplo de cálculo da molalidade de uma solução de NaOH em água.
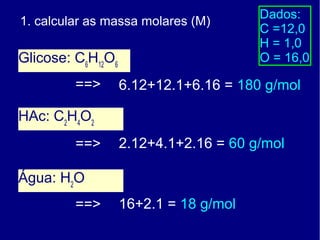
3) É apresentado também um exercício para calcular a fração molar de ácido acético em uma solução contendo glicose, ácido acético e água.