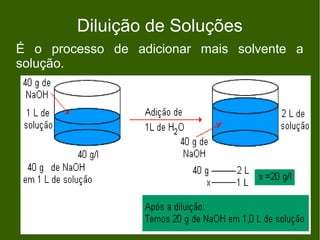
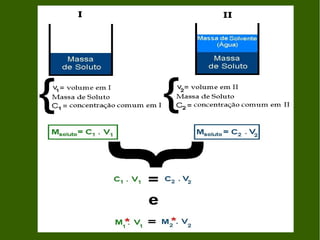
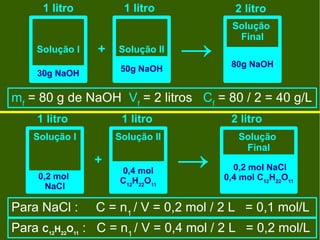
1) O documento descreve processos de diluição de soluções e mistura de soluções, incluindo cálculos de concentração final.
2) É apresentado um exemplo de exercício sobre diluição de solução de fosfato de sódio e outro sobre mistura de solução de cloreto de sódio.
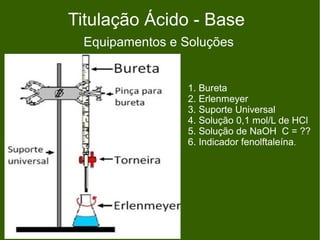
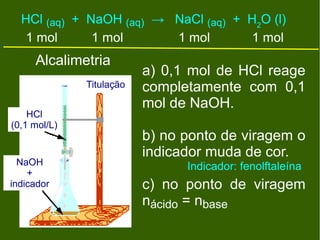
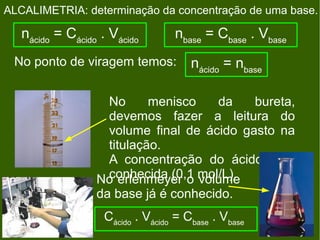
3) Os principais equipamentos e soluções utilizados em titulação ácido-base são listados, assim como as etapas de uma titulação e alcalimetria.