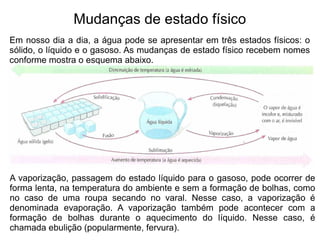
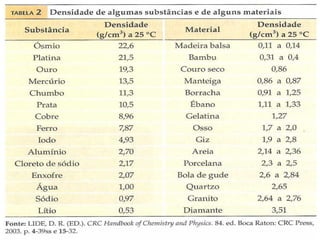
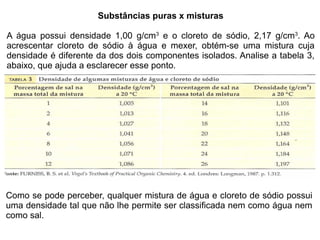
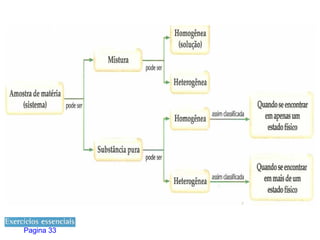
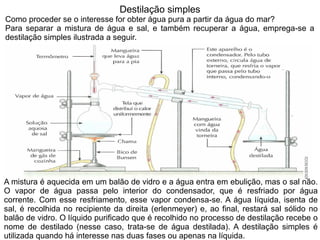
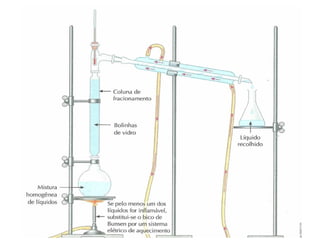
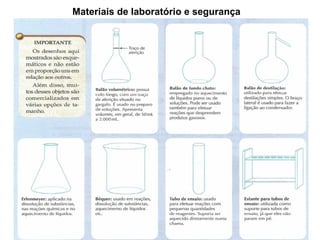
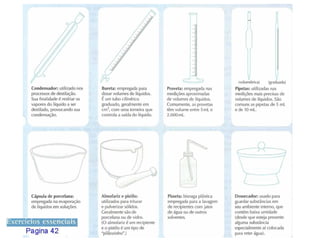
1) O documento discute estados físicos da matéria, incluindo mudanças de estado como fusão e ebulição.
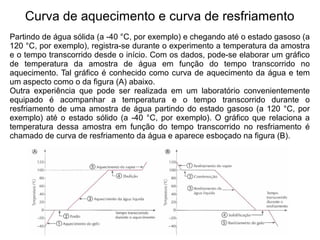
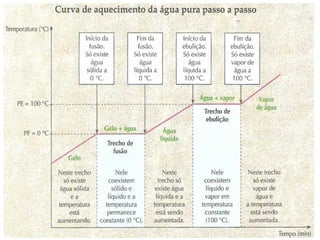
2) São apresentadas curvas de aquecimento e resfriamento que mostram como a temperatura varia durante essas mudanças de estado.
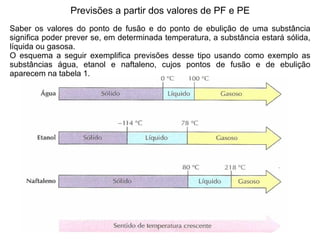
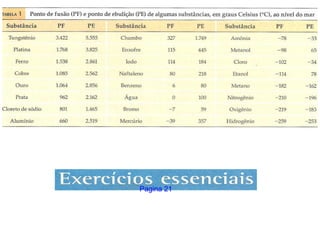
3) Os conceitos de ponto de fusão e ponto de ebulição são explicados e exemplos são dados para a água, etanol e naftaleno.