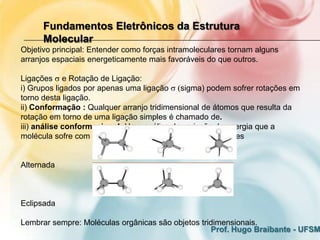
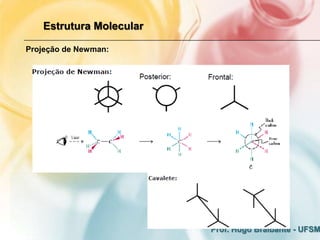
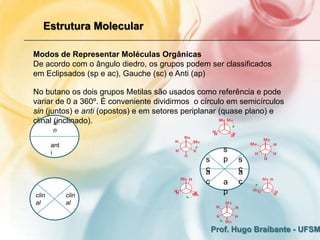
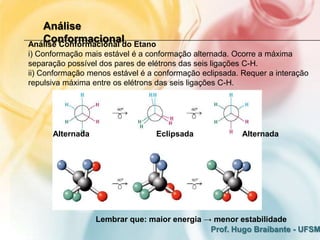
O documento discute os fundamentos eletrônicos da estrutura molecular, incluindo:
1) A estrutura molecular pode ser discutida em termos de distância intramolecular entre átomos, que pode ser monodimensional, bidimensional ou tridimensional.
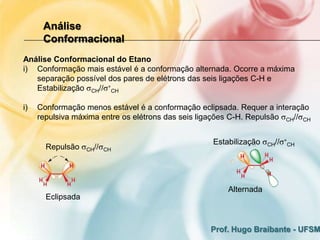
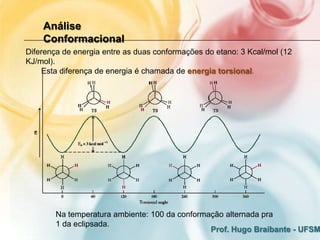
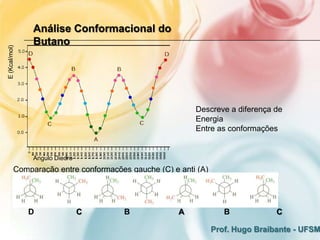
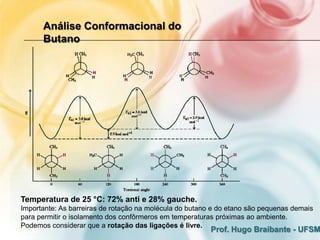
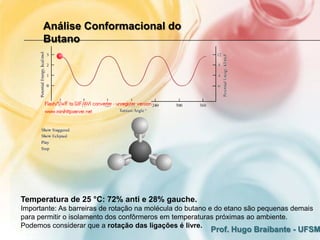
2) A análise conformacional de moléculas como etano e butano mostra que arranjos que minimizam interações eletrônicas repulsivas são mais estáveis.
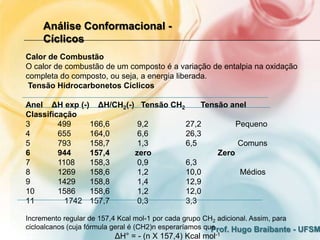
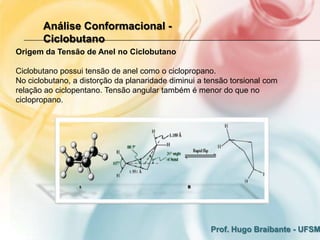
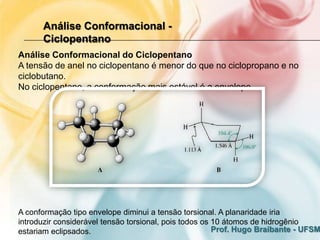
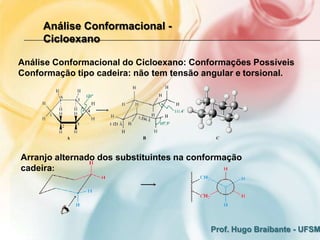
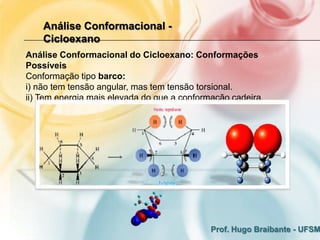
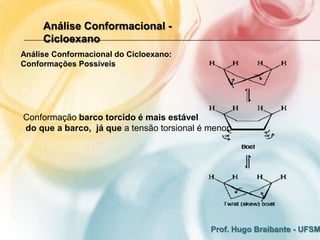
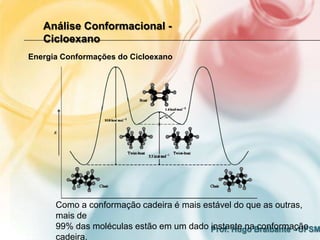
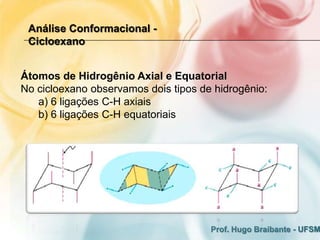
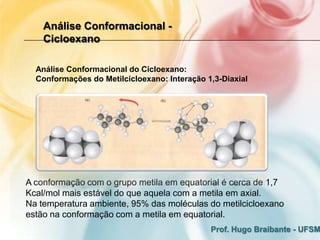
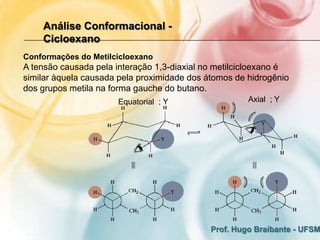
3) A análise de cicloalcanos mostra que a conformação cadeira do cicloexano minimiza tens