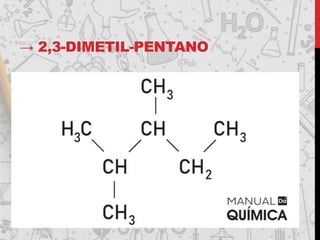
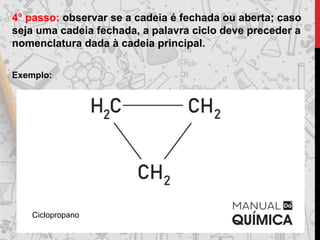
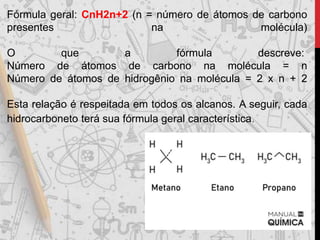
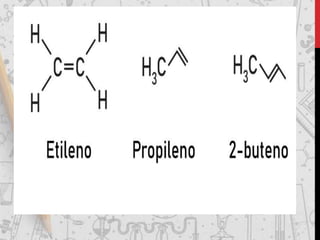
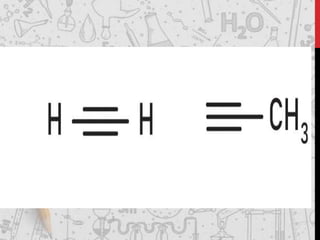
Os hidrocarbonetos são compostos orgânicos formados por carbono e hidrogênio. Eles podem ser classificados como alcanos, alcenos, alcinos e alcadienos dependendo da presença de ligações simples, duplas ou triplas entre os átomos de carbono. A nomenclatura dos hidrocarbonetos leva em conta o número de carbonos, ramificações e insaturações presentes na molécula.



![Densidade
Os hidrocarbonetos possuem densidade inferior à da
água.
→ Solubilidade
São majoritariamente insolúveis em compostos
polares. [( apresentam polos (positivo e negativo)]
→ Reatividade
A reatividade varia conforme a cadeia.
• Baixa reatividade: moléculas acíclicas (cadeia
aberta) e saturadas (apenas ligações simples).
• Moderada reatividade: compostos acíclicos com
instaurações (duplas ou triplas ligações).
• Alta reatividade: compostos cíclicos (cadeia
fechada) com 3 a 5 carbonos na cadeia.](https://image.slidesharecdn.com/aula01-210324142913/85/HIDROCARBONETOS-4-320.jpg)