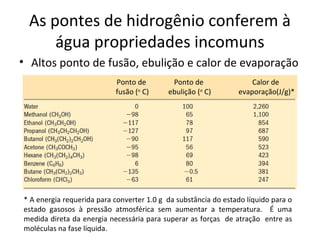
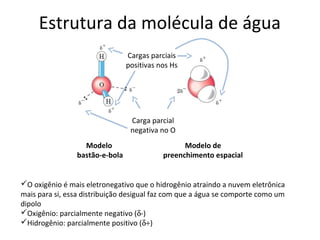
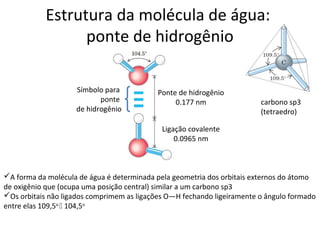
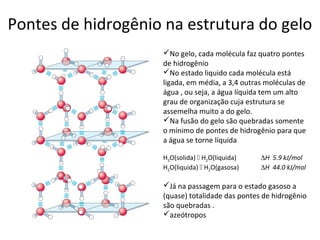
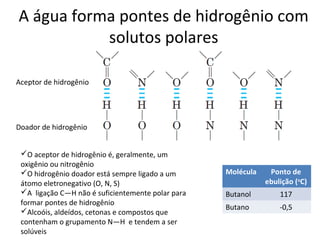
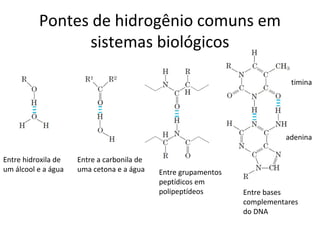
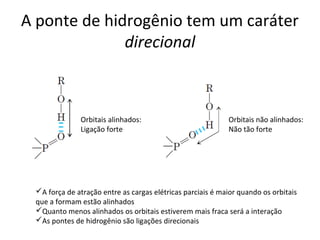
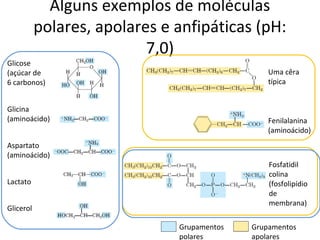
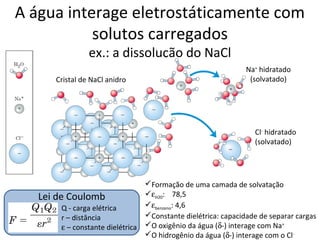
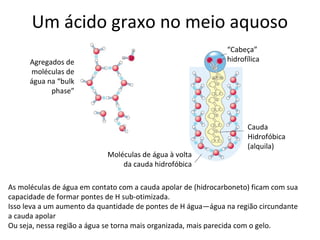
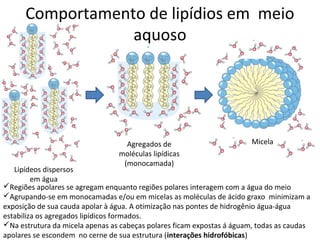
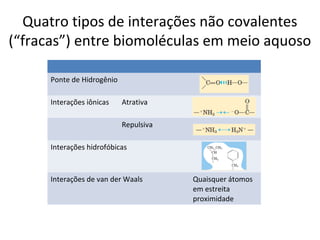
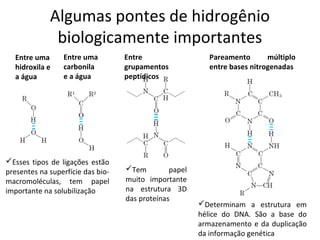
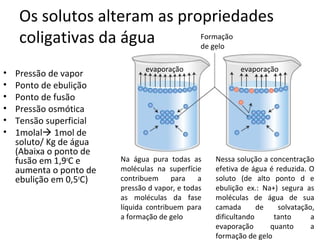
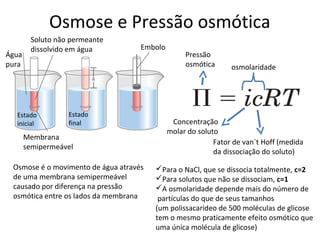
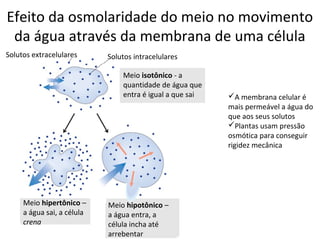
A água é a molécula mais abundante nos sistemas vivos e teve um papel fundamental na origem da vida e evolução. Suas propriedades físico-químicas, como as pontes de hidrogênio, conferem características únicas à água e permitem que ela desempenhe funções vitais como solvente e meio de transporte.