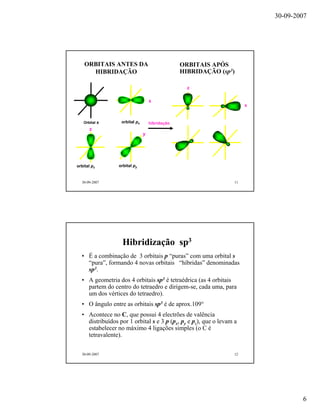
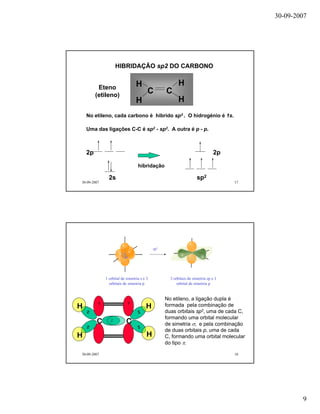
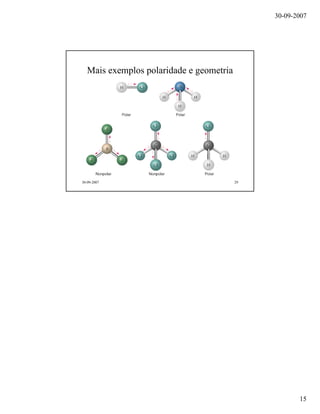
O documento discute conceitos de geometria molecular, hibridação de orbitais e ligações químicas. Explica como a hibridação sp, sp2 e sp3 dos átomos de carbono determina a geometria molecular de compostos como metano, etano, eteno e acetileno. Também aborda como a diferença de eletronegatividade entre átomos gera polaridade em moléculas como o fluoreto de hidrogênio.