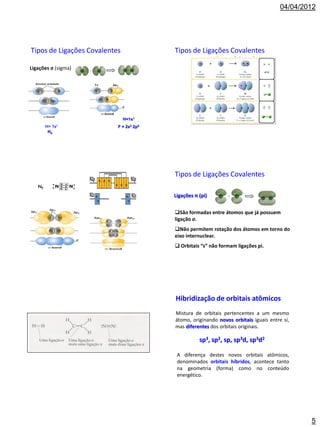
[1] O documento discute geometria molecular, ressonância, tipos de ligação e hibridização de orbitais atômicos.
[2] É explicado que a geometria molecular depende da minimização da repulsão entre pares de elétrons na camada de valência, determinada pelo modelo VSEPR.
[3] São apresentados exemplos de moléculas com geometrias lineares, trigonais planas, tetraédricas e piramidais trigonais resultantes da hibridização sp, sp2 e sp3.