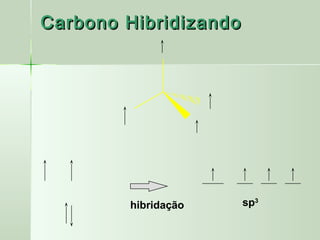
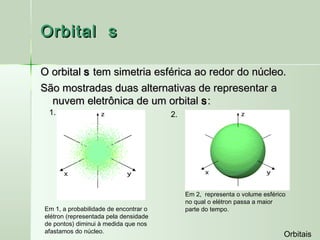
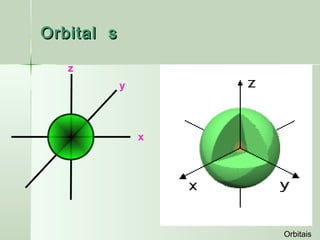
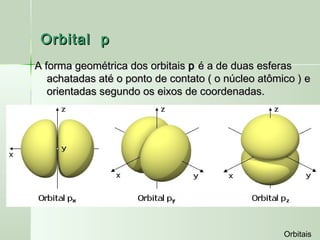
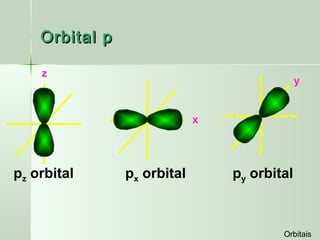
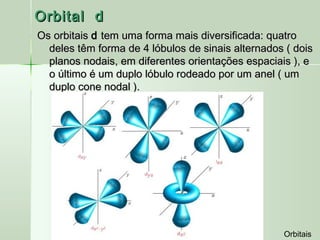
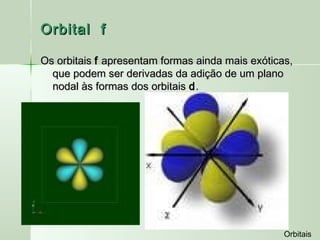
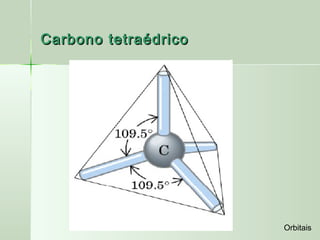
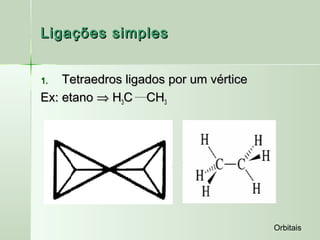
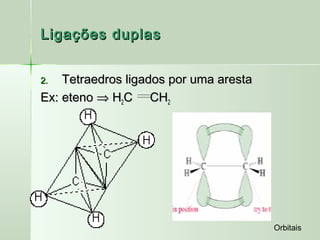
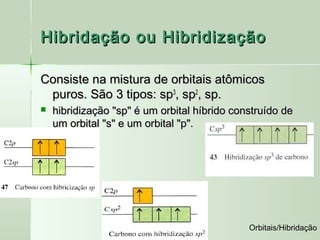
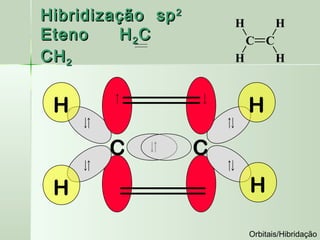
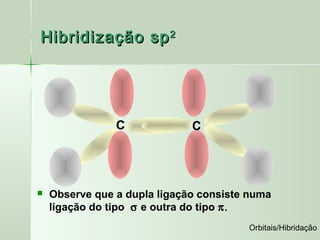
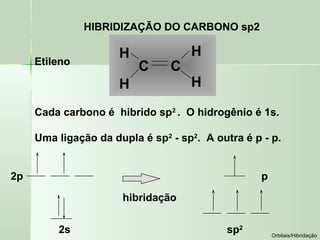
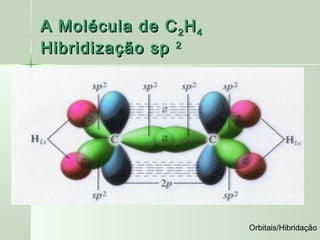
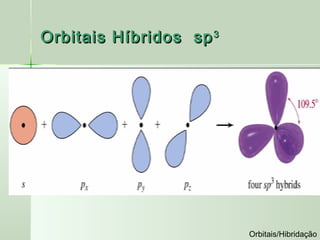
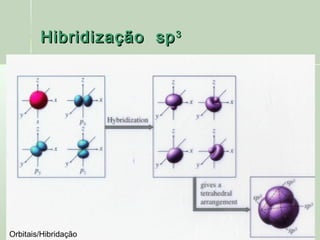
O documento descreve os conceitos de orbitais e hibridização no carbono. Resume que orbitais representam regiões de maior probabilidade de encontrar elétrons e que o carbono pode formar diferentes tipos de ligação dependendo da hibridização sp, sp2 ou sp3 dos seus orbitais atômicos. A hibridização resulta na mistura dos orbitais atômicos originando novos orbitais híbridos que determinam a geometria e tipo de ligação das moléculas.







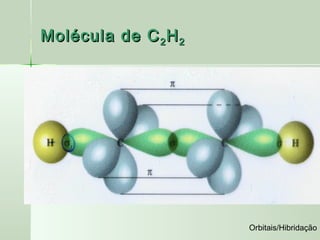
![Tipos de ligações no C 2 H 2
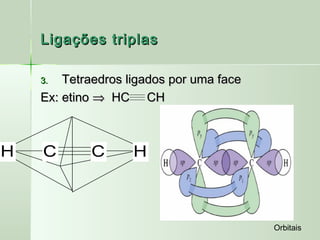
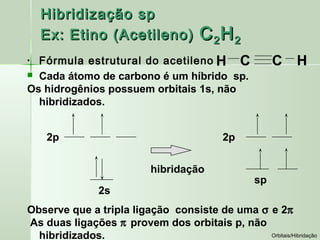
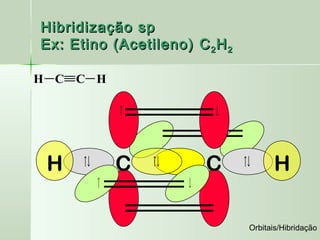
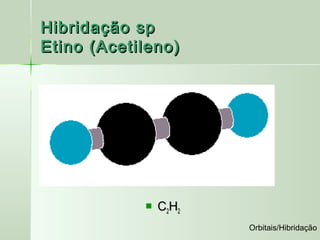
No acetileno existem 3 tipos de ligações:
ligações sigma s-sp; ligação sigma sp-sp;
ligações pi
[sp (C 1 ) – 1s (H) ] x 2 tipo σ
[sp (C 1 ) – sp (C 2 ) ] tipo σ
[2p (C 1 ) – 2p (C 2 ) ] tipo π
y y
[2pz (C 1 ) – 2pz (C 2 ) ] tipo π
Orbitais/Hibridação](https://image.slidesharecdn.com/orbitais-121130144558-phpapp02/85/Orbitais-moleculares-23-320.jpg)





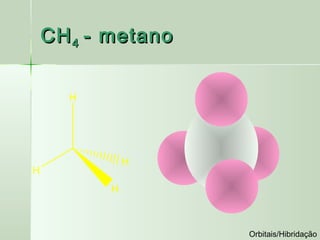
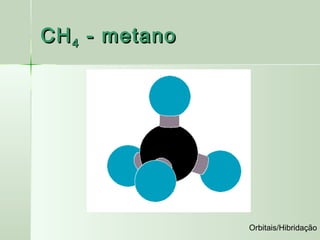
![Exemplo de ligação sp 3 -> CH 4
No CH4, os 4 orbitais híbridos sp 3 do C
se ligam com os orbitais s de 4 átomos
de H, formando 4 ligações sigma C-H
[sp3 (C) – 1s (H) ] x 4 ligação σ
Orbitais/Hibridação](https://image.slidesharecdn.com/orbitais-121130144558-phpapp02/85/Orbitais-moleculares-35-320.jpg)