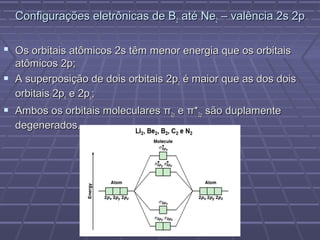
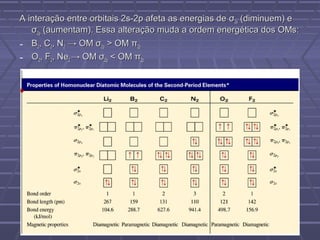
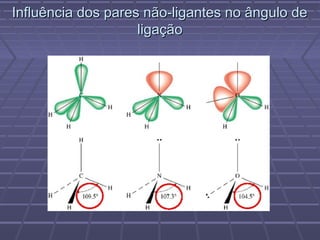
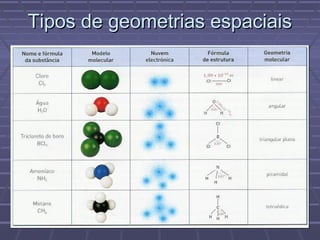
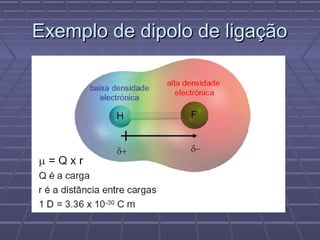
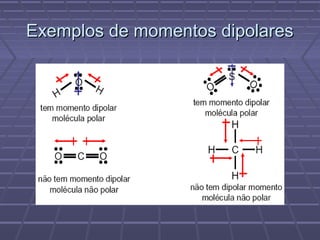
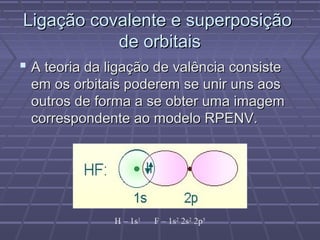
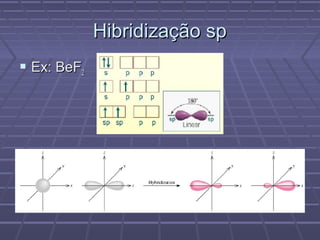
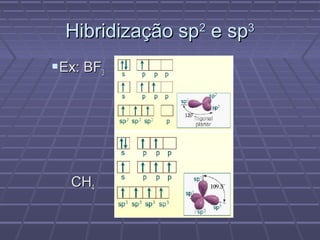
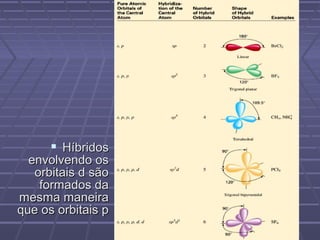
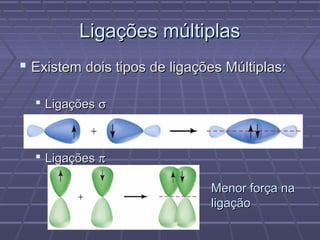
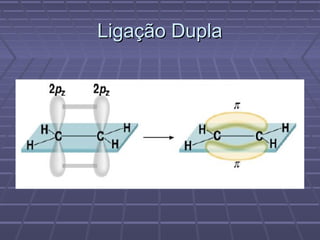
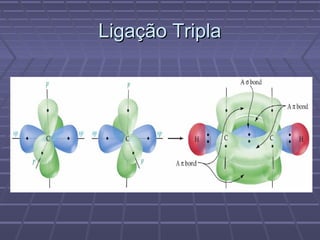
O documento discute geometria molecular e teorias de ligação, incluindo formas espaciais moleculares, o modelo RPENV, polaridade molecular, ligação covalente, hibridização de orbitais, ligações múltiplas e moléculas diatômicas do segundo período. Explica como a distribuição eletrônica determina propriedades como paramagnetismo e diamagnetismo.








![Orbitais moleculares para:
Li2→ 1s2 2s1
1s e 2s: diferentes energias;
1s formam orbitais ligante σ1s e anti-
ligante σ*1s
2s: mais distantes do núcleo / maior
superposição / maior separação de
energia;
1s: mais baixos em energia que 2s.
½ (4 – 2) = 1 (ligação simples)
Obs.: os elétrons do cerne [Ne] não
interferem na ligação.
Be2 → 1s2 2s2
Segue mesmas regras de Li2, mas Diagrama para Li2: a
com oito elétrons nos OMs, logo: ligação tem seis elétrons
½ (4 – 4) = 0 (não existe ligação) nos OMs.](https://image.slidesharecdn.com/eco-09-121204125114-phpapp01/85/Eco-09-20-320.jpg)