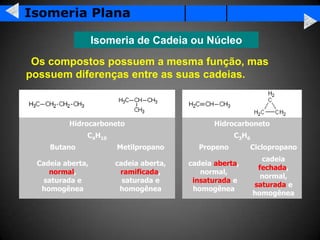
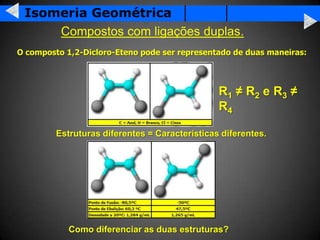
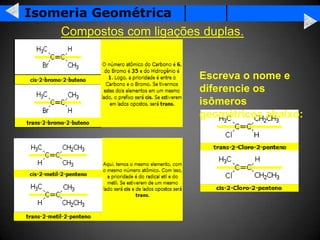
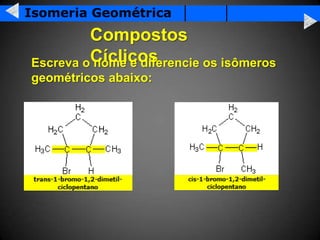
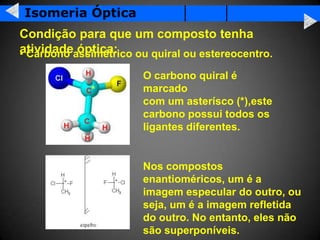
A isomeria é o fenômeno pelo qual compostos com a mesma fórmula molecular podem ter propriedades diferentes devido à disposição dos átomos na molécula. Existem dois tipos principais de isomeria: isomeria plana, que ocorre devido à posição dos grupos funcionais ou átomos na estrutura de Lewis, e isomeria espacial, que ocorre devido à orientação dos grupos no espaço. A isomeria óptica é um tipo especial de isomeria espacial onde compostos podem desviar a luz polar