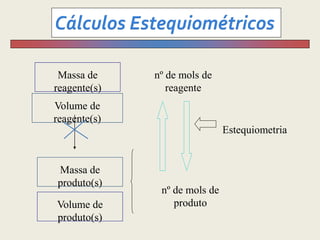
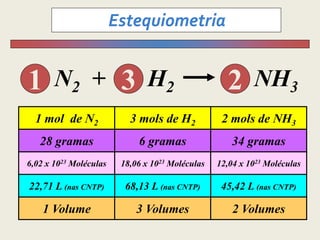
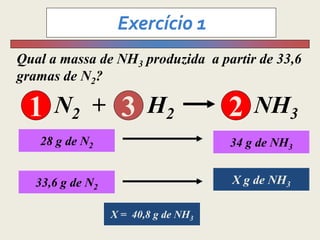
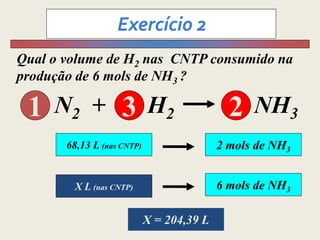
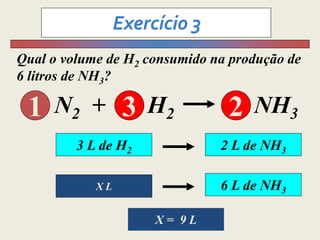
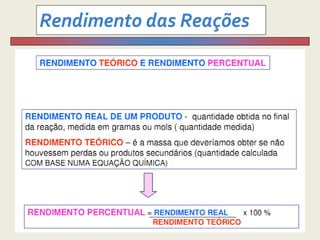
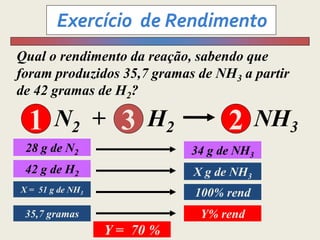
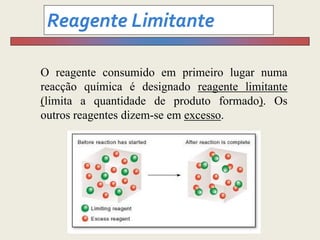
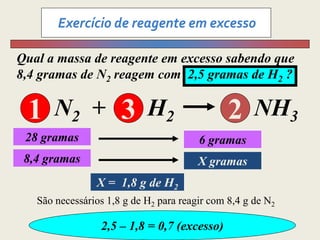
1) O documento discute estequiometria, que é a relação entre a massa ou volume de reagentes e produtos em uma reação química.
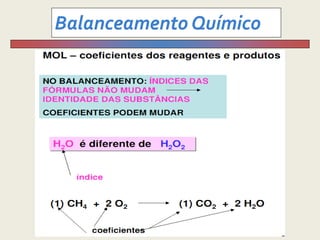
2) Explica como balancear equações químicas para que os átomos sejam conservados.
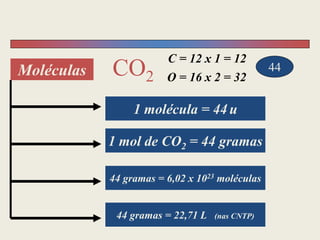
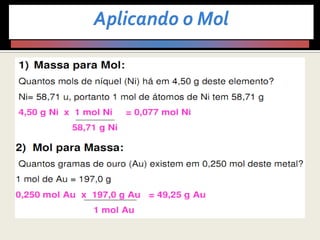
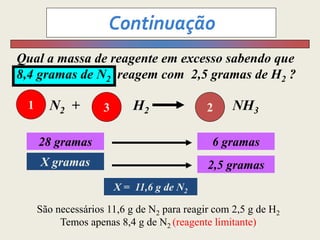
3) Demonstra cálculos estequiométricos para determinar massas, volumes e rendimentos em reações químicas.