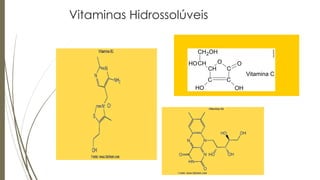
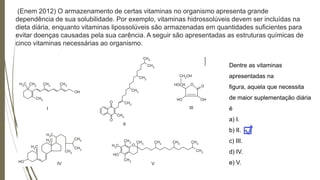
[1] O documento discute solubilidade e polaridade de substâncias, e como isso determina a capacidade de sabões e detergentes de remover sujeiras. [2] A solubilidade depende da polaridade das substâncias, com substâncias polares se dissolvendo em outras polares e apolares em outras apolares. [3] Sabões e detergentes contém grupos hidrofóbicos e hidrofílicos que permitem remover sujeiras apolares e polares da roupa.