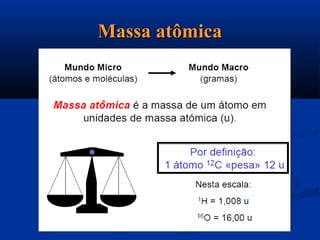
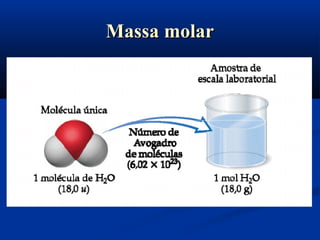
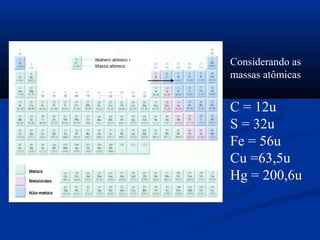
Este documento apresenta conceitos fundamentais de cálculo estequiométrico em química, incluindo massa atômica, massa molecular, número de Avogadro, reações químicas e relações massas em reações. Exemplos e exercícios são fornecidos para demonstrar o cálculo de quantidades em mols e números de partículas em amostras químicas.