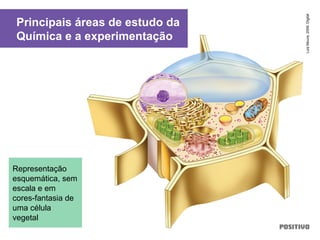
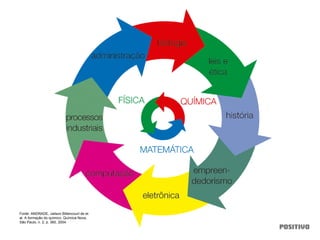
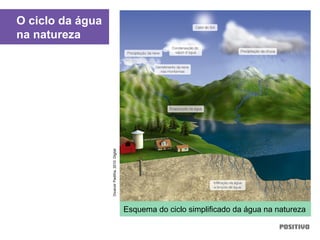
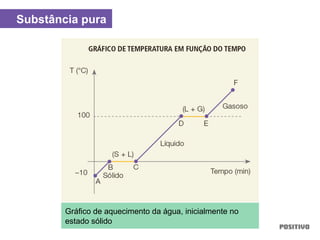
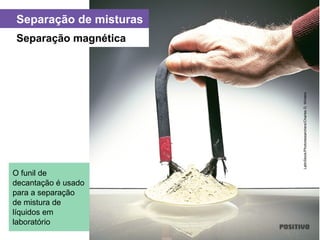
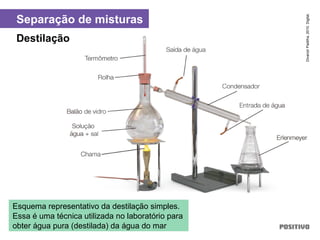
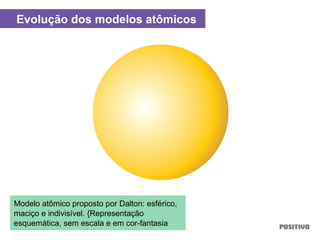
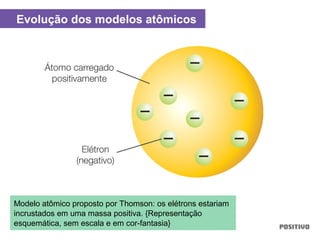
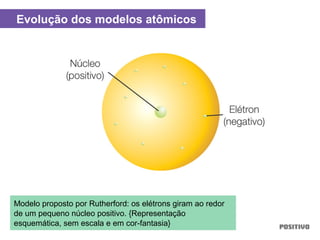
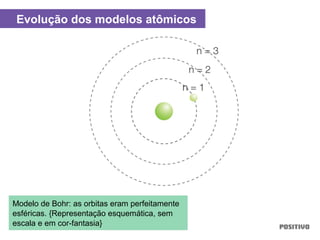
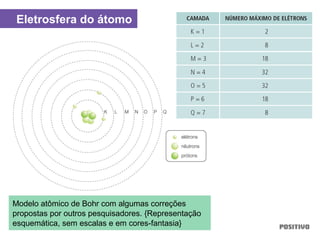
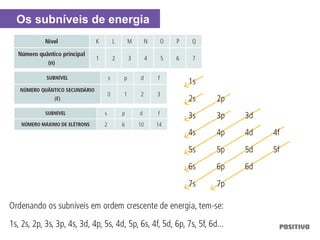
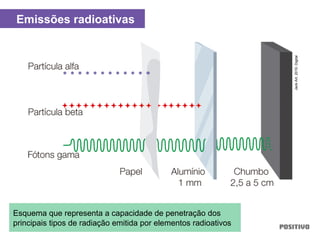
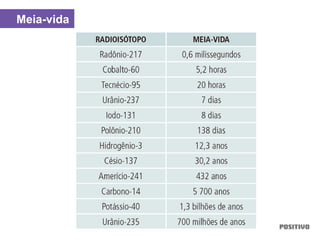
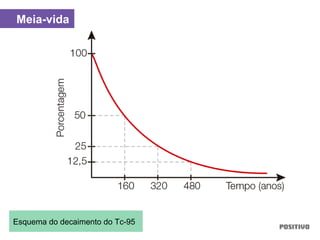
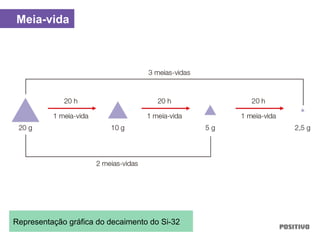
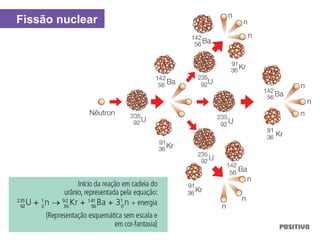
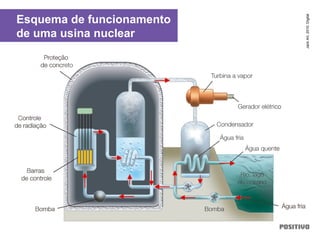
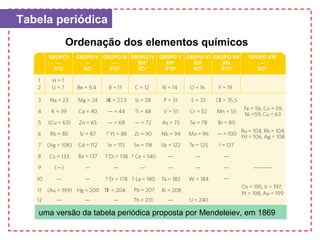
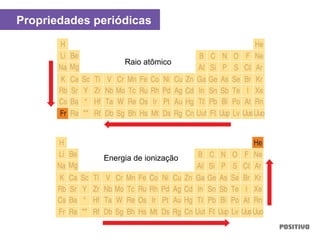
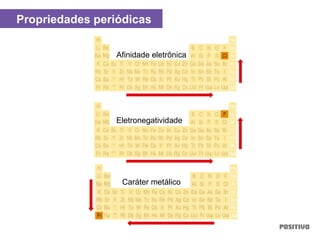
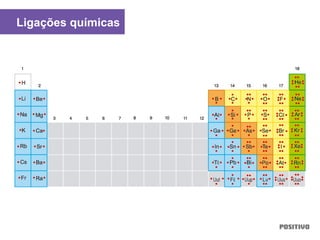
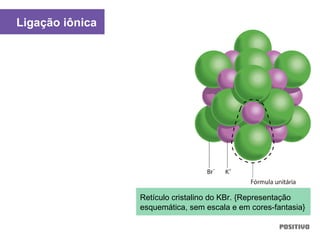
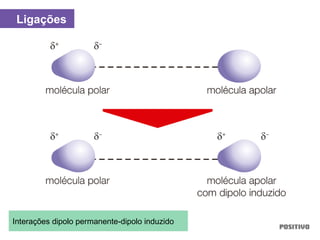
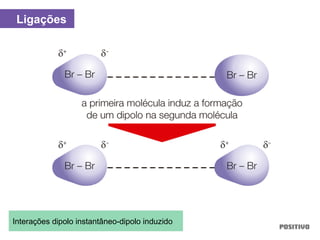
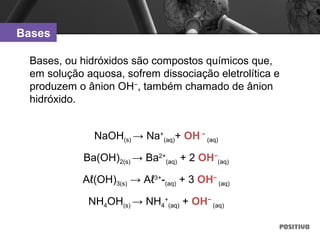
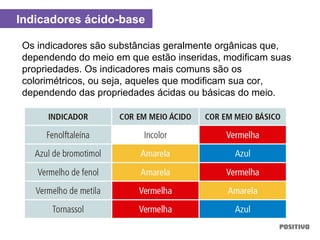
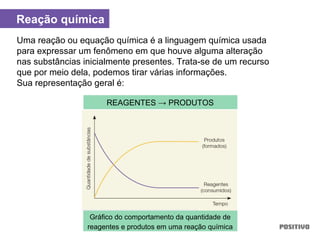
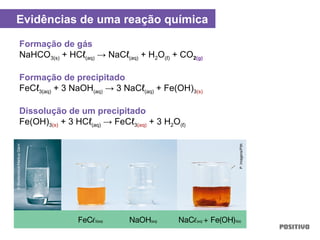
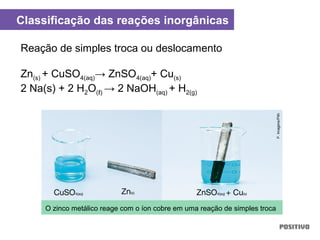
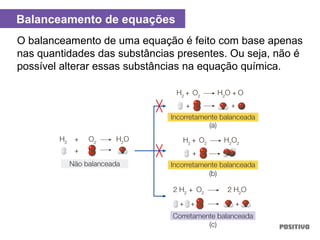
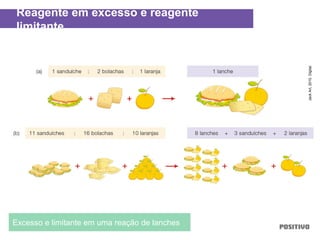
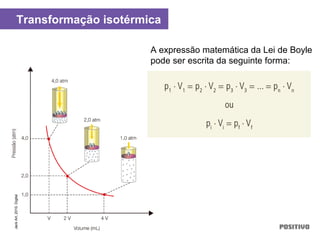
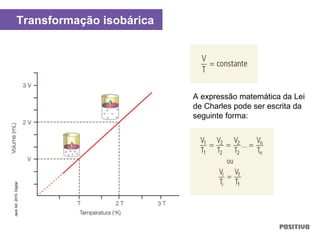
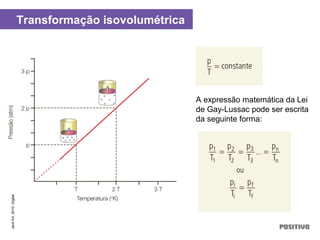
O documento apresenta um capítulo sobre química geral. Aborda tópicos como introdução à química, áreas de estudo da química, experimentação, modelos atômicos, radioatividade, tabela periódica, ligações químicas, ácidos, bases, reações químicas e propriedades da matéria.