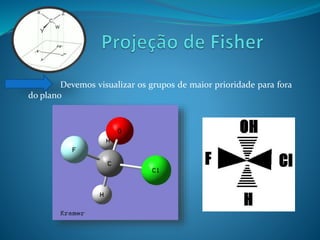
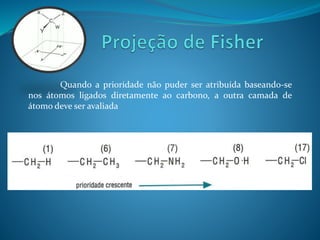
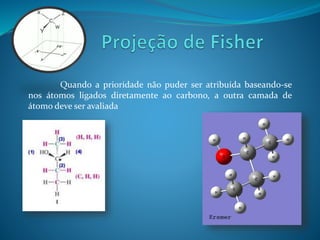
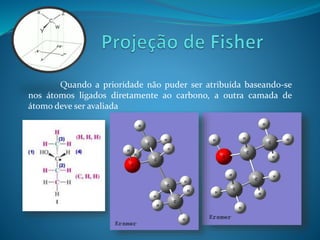
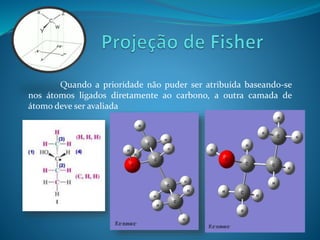
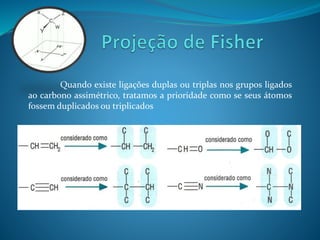
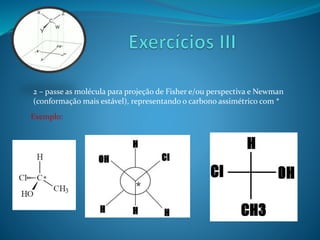
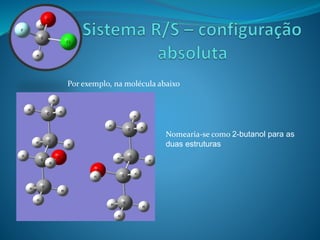
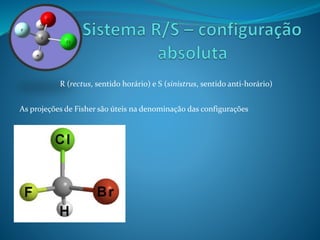
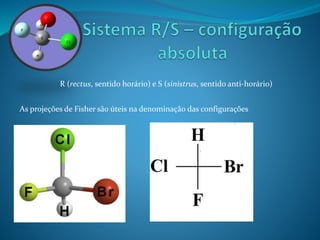
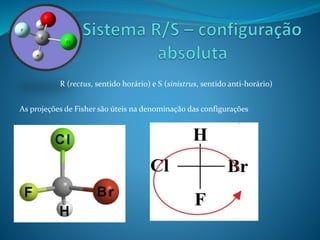
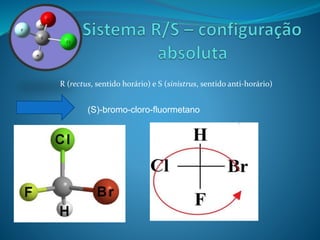
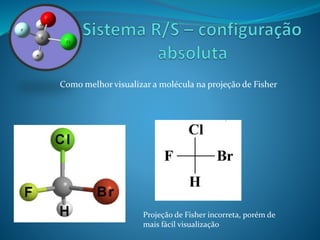
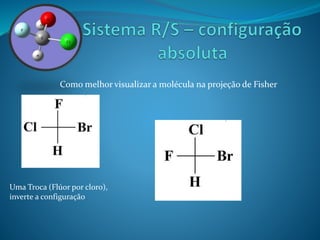
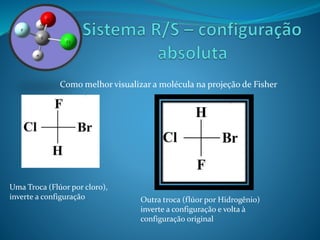
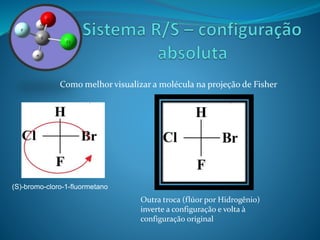
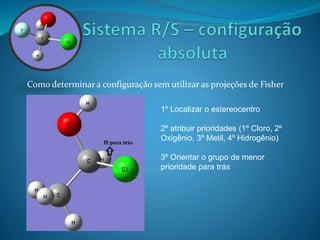
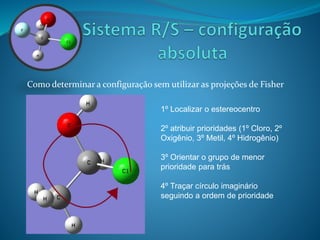
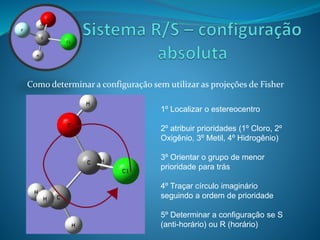
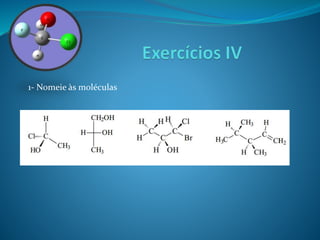
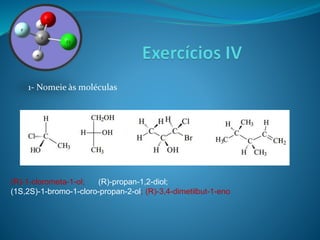
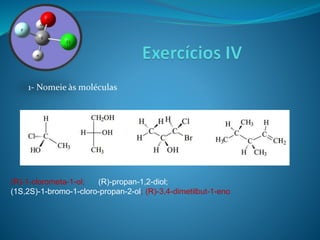
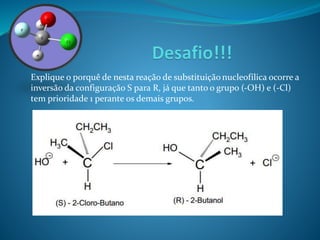
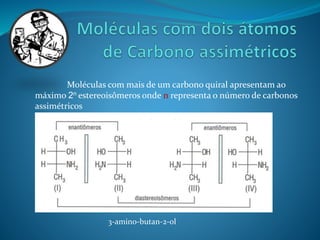
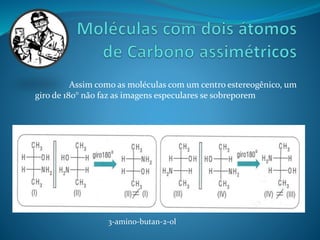
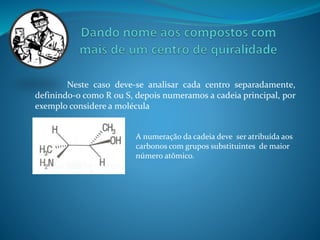
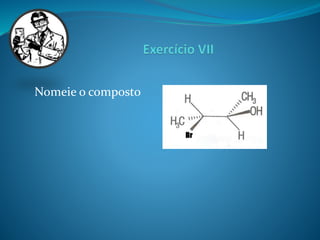
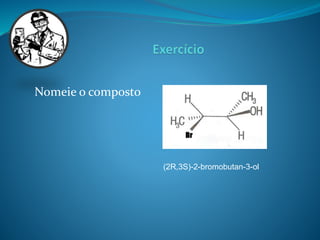
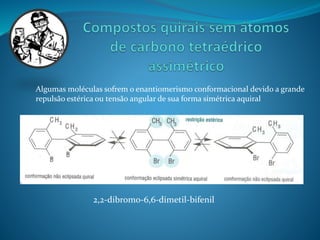
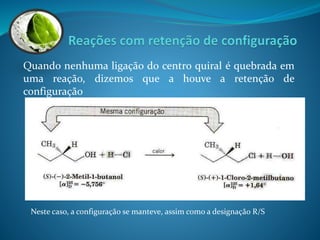
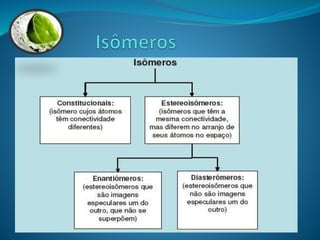
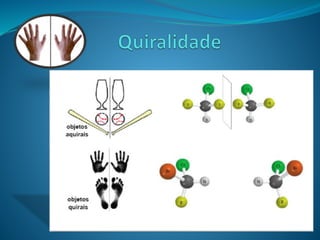
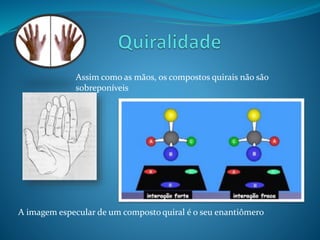
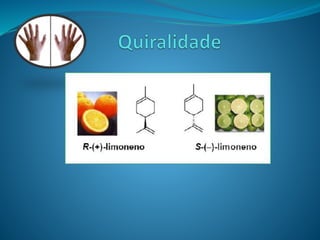
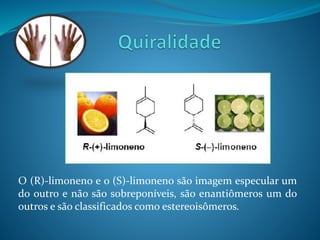
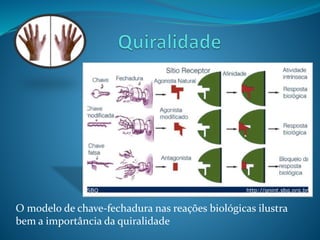
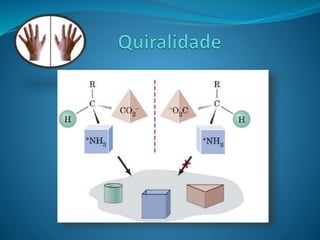
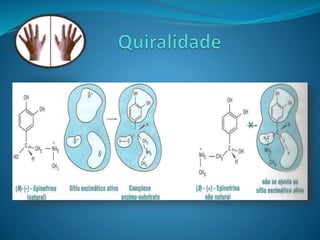
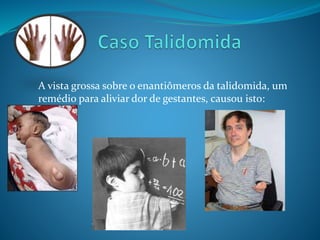
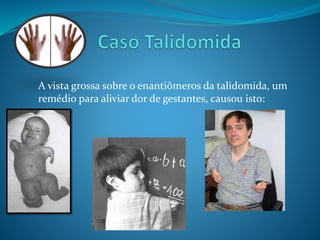
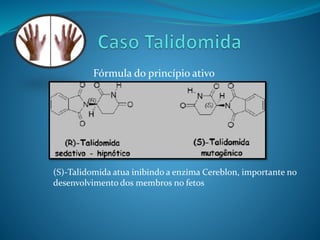
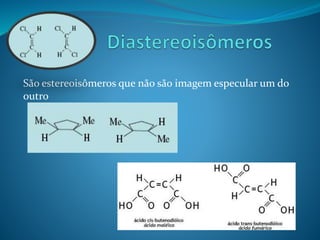
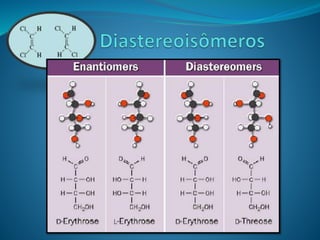
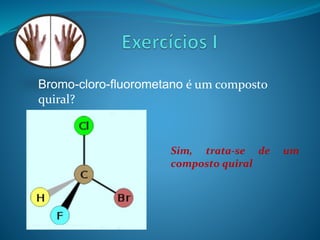
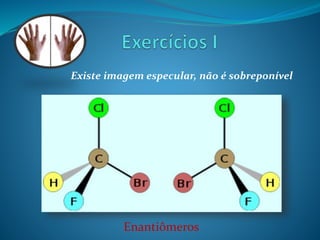
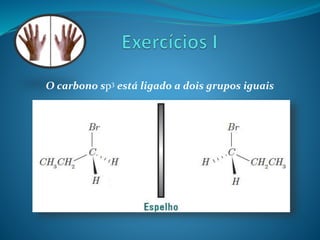
O documento discute estereoquímica, incluindo isomeria, quiralidade e propriedades ópticas de compostos. Explica que a estereoquímica estuda a organização tridimensional de moléculas e como isso afeta suas propriedades. Também discute como o limoneno em laranjas e limões gera odores diferentes e como a quiralidade da talidomida causou defeitos de nascimento.



































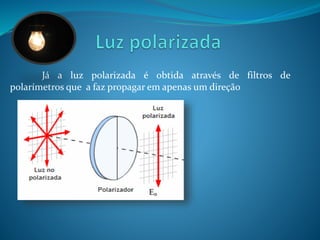
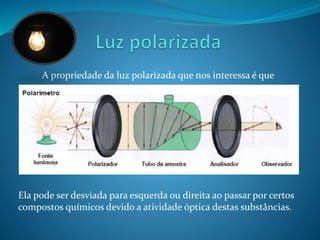
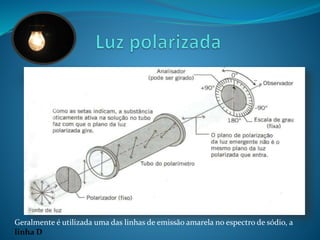


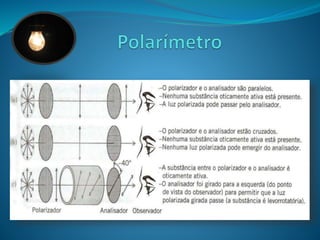

![O desvio da luz polarizada por compostos opticamente
ativos depende de alguns fatores, como o comprimento do tubo e
concentração do composto.
[α] = __α___
c.l
[α] = a rotação específica
α = a rotação observada
c = concentração em g. ml-1
l = comprimento do tubo em dm](https://image.slidesharecdn.com/estereoqumica-140917075556-phpapp02/85/Minicurso-de-Estereoquimica-de-com-62-320.jpg)
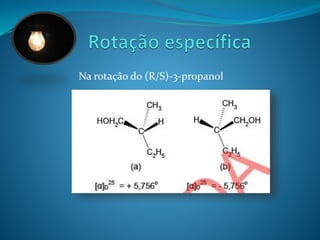
![Na rotação do (R/S)-3-propanol
Não existe co-relação no sistema R/S com os
enantiômeros [(+) ou (-)]](https://image.slidesharecdn.com/estereoqumica-140917075556-phpapp02/85/Minicurso-de-Estereoquimica-de-com-64-320.jpg)
![Não existe co-relação no sistema R/S com os
enantiômeros [(+) ou (-)]](https://image.slidesharecdn.com/estereoqumica-140917075556-phpapp02/85/Minicurso-de-Estereoquimica-de-com-65-320.jpg)









![Uma solução preparada pela dissolução de 400 mg de
testosterona em 10,0 ml de etanol, foi colocada em um tudo de 10,0
cm de comprimento, a rotação observada a 25°C, usando a linha D
de sódio, foi +4,36°. Qual a rotação específica?
[α] = __α___
c.l
[α] = __+4,36___
1,00 x 0,0400
Nota: 1 dm = 10 cm](https://image.slidesharecdn.com/estereoqumica-140917075556-phpapp02/85/Minicurso-de-Estereoquimica-de-com-75-320.jpg)
![Uma solução preparada pela dissolução de 400 mg de
testosterona em 10,0 ml de etanol, foi colocada em um tudo de 10,0
cm de comprimento, a rotação observada a 25°C, usando a linha D
de sódio, foi +4,36°. Qual a rotação específica?
[α] = __α___
c.l
[α] = __+4,36___
1,00 x 0,0400
Nota: 1 dm = 10 cm
[α] = + 109](https://image.slidesharecdn.com/estereoqumica-140917075556-phpapp02/85/Minicurso-de-Estereoquimica-de-com-76-320.jpg)