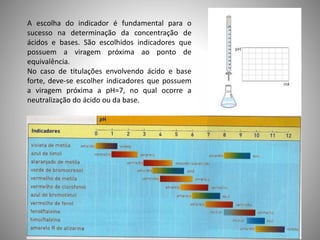
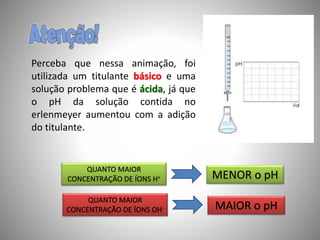
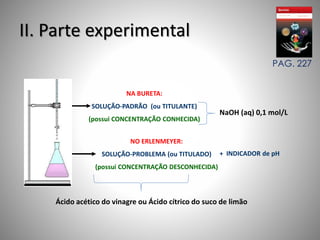
O documento descreve o processo de titulação ácido-base como um método para determinar a concentração de ácidos e bases. A titulação envolve a adição controlada de uma solução de concentração conhecida (titulante) até o ponto de equivalência, indicado pela mudança de cor de um indicador. Isso permite calcular a concentração da solução problema (titulado) por meio de equações estequiométricas. Exemplos práticos são fornecidos para ácido acético, ácido cítrico e hidróxido