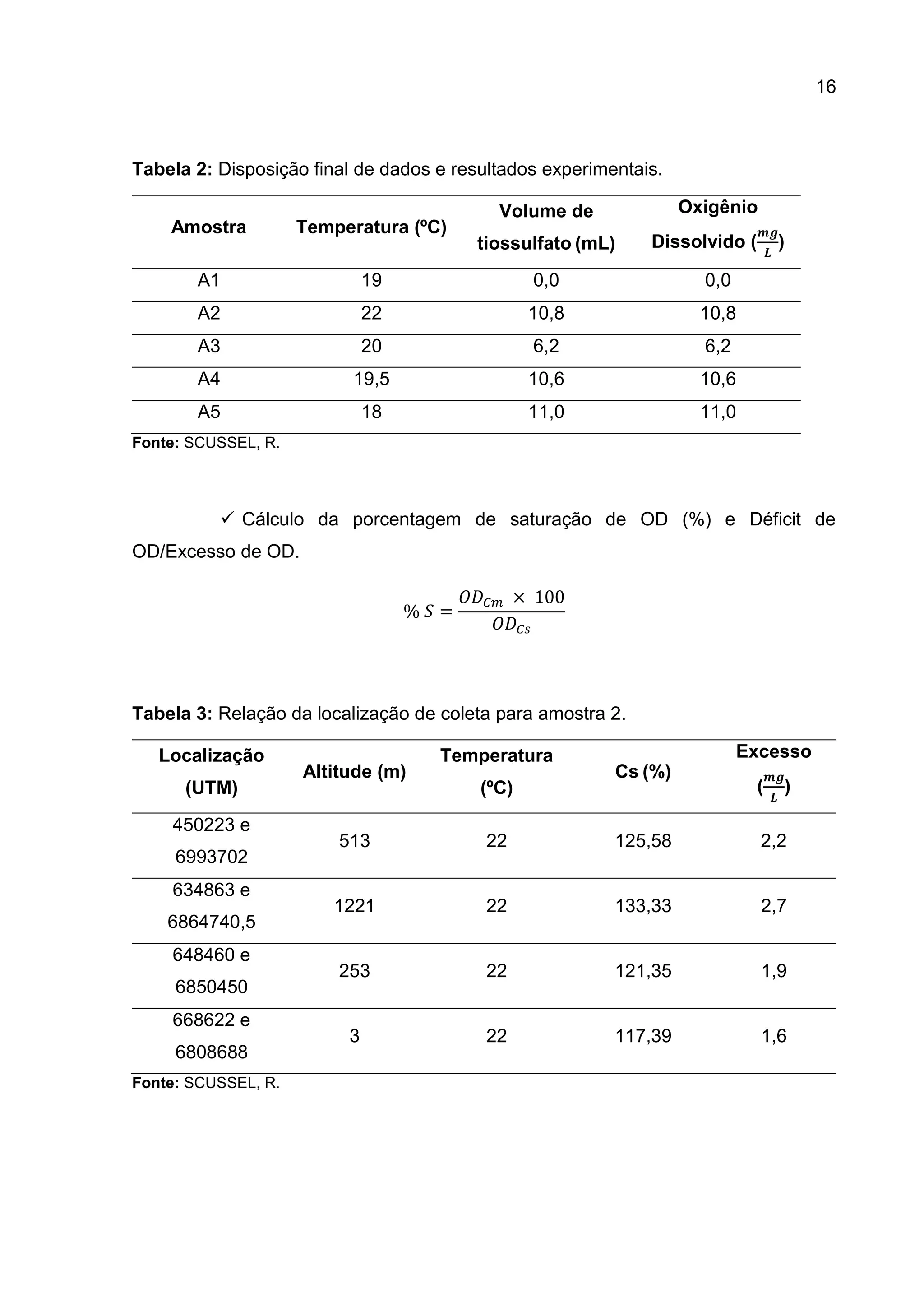
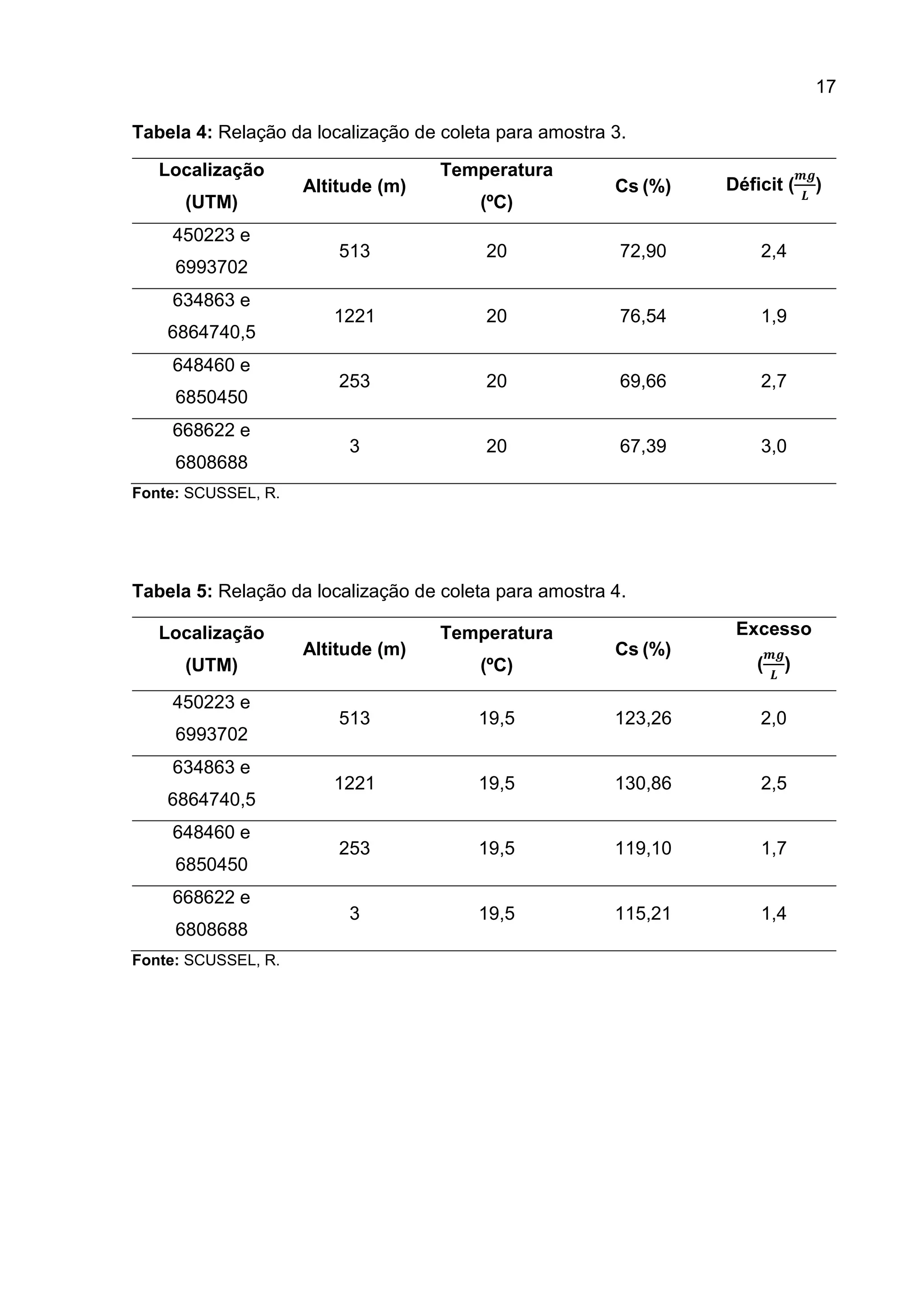
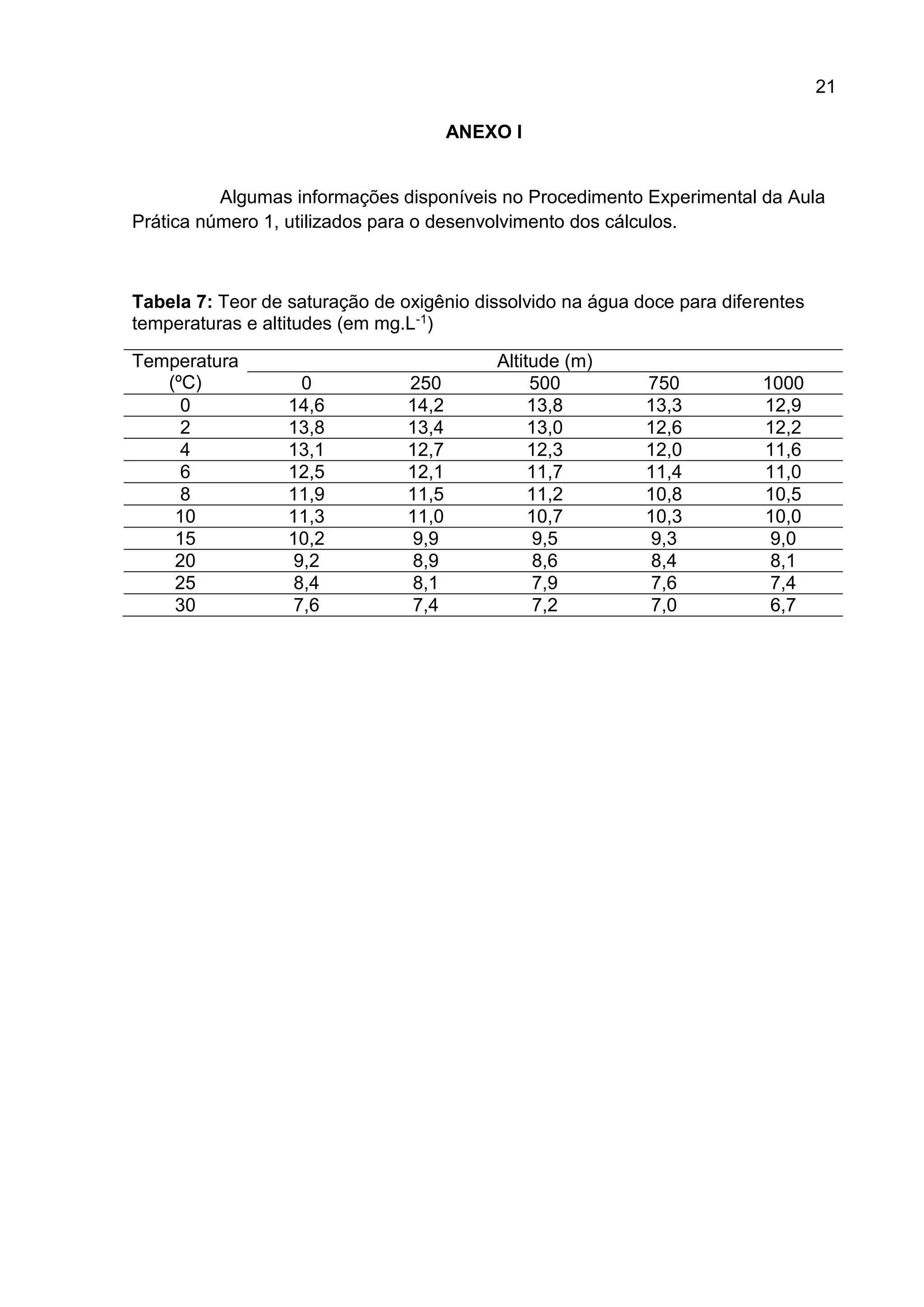
1. O documento descreve um estudo que teve como objetivo determinar o oxigênio livre dissolvido em cinco amostras de água através do método iodométrico de Winkler.
2. Foram realizados procedimentos como coleta das amostras, adição de reagentes químicos como sulfato de manganês e álcali-iodeto-azida, titulação com tiossulfato de sódio e cálculo da concentração de oxigênio dissolvido.
3. Os resultados experimentais