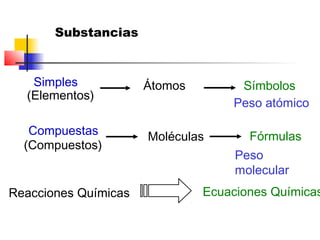
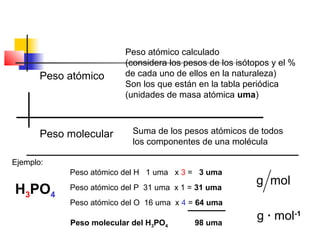
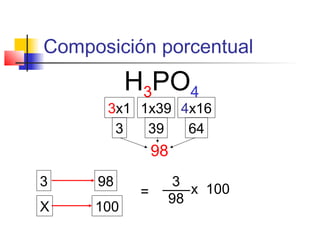
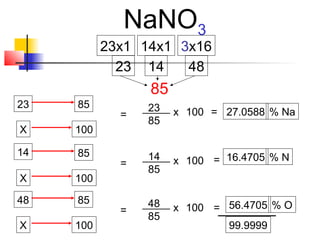
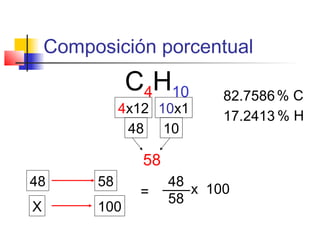
El documento describe conceptos básicos de química cuantitativa como el número de Avogadro, peso atómico, peso molecular, mol y fórmulas químicas. Explica cómo calcular las masas molares de sustancias a partir de su composición porcentual y como determinar las fórmulas empíricas y moleculares.