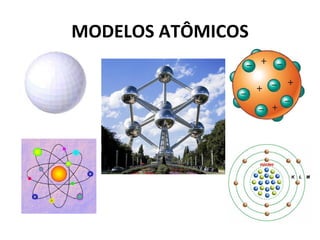
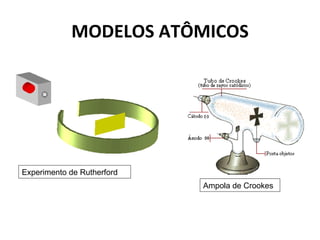
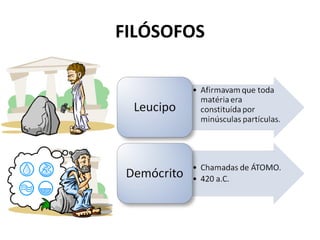
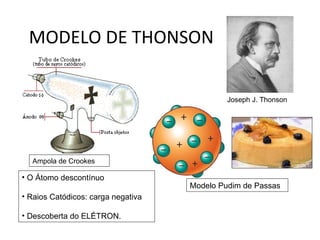
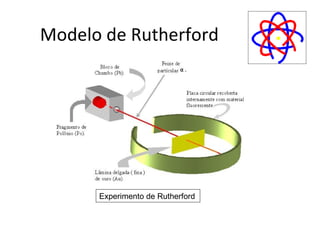
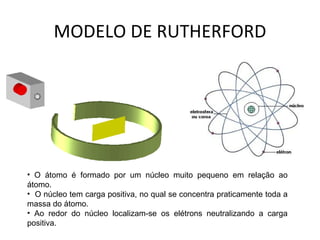
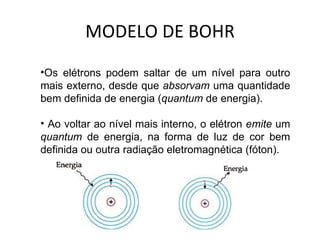
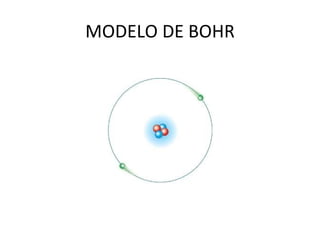
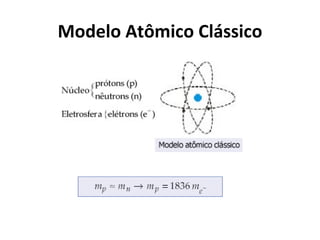
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelo modelo de Dalton no século XIX, que via os átomos como esferas indivisíveis. Posteriormente, os modelos de Thomson e Rutherford introduziram a ideia de que os átomos possuem estrutura interna, com elétrons e um núcleo central. Finalmente, o modelo de Bohr propôs que os elétrons orbitam o núcleo em níveis de energia discretos.