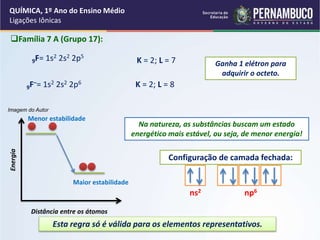
O documento descreve as ligações iônicas, o processo pelo qual os átomos se unem através da transferência de elétrons de um metal para um não-metal. Explica que os metais tornam-se cátions ao perderem elétrons, enquanto os não-metais tornam-se ânions ao ganharem elétrons, de modo que ambos adquiram o octeto de elétrons. Apresenta exemplos como o cloreto de sódio, onde o sódio se torna Na+ e o cloro Cl-.