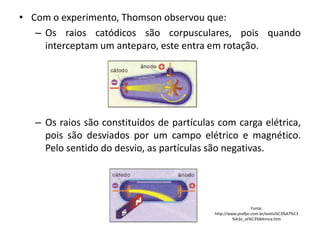
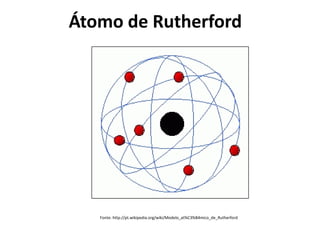
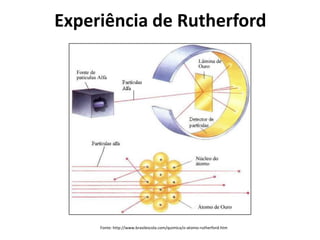
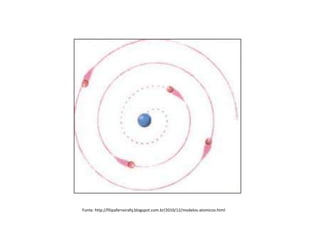
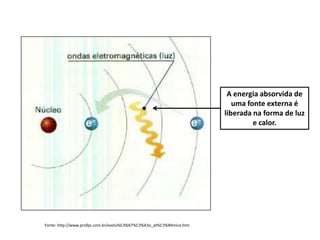
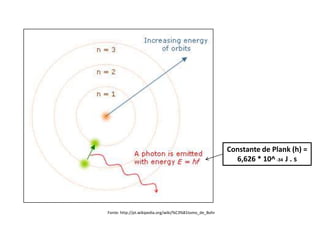
O documento descreve a evolução dos modelos atômicos ao longo da história, desde o modelo de Dalton, passando pelo modelo de Thomson, Rutherford até chegar no modelo atômico de Bohr. Resume as principais características e descobertas científicas que levaram ao desenvolvimento de cada um desses modelos atômicos.