1) O documento descreve o trabalho de Niels Bohr, um físico dinamarquês que fez contribuições importantes para o modelo atômico no início do século 20.
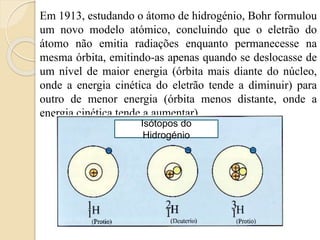
2) Bohr propôs em 1913 que os elétrons orbitam o núcleo em níveis de energia discretos, o que ajudou a explicar propriedades dos átomos de hidrogênio.
3) Seu modelo atômico melhorou o entendimento anterior proposto por Rutherford e ajudou no desenvolvimento da mecânica quântica.