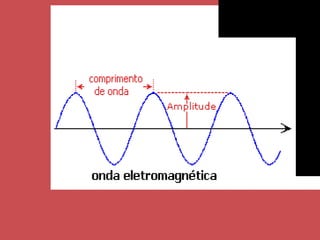
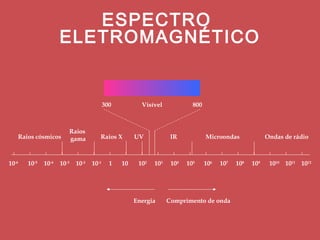
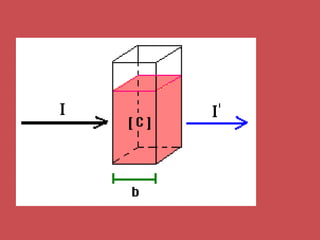
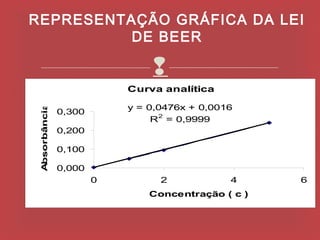
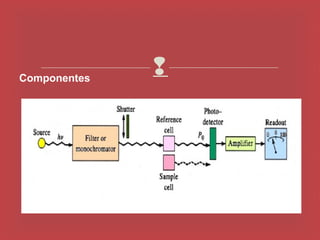
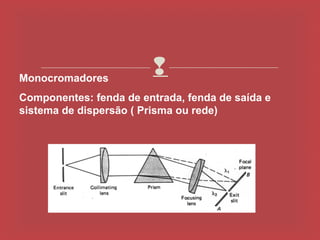
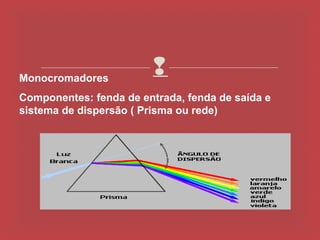
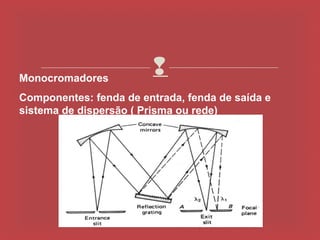
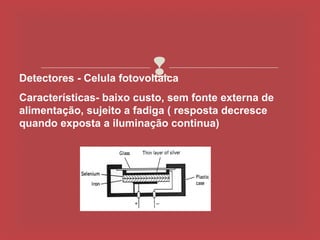
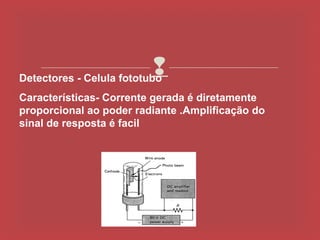
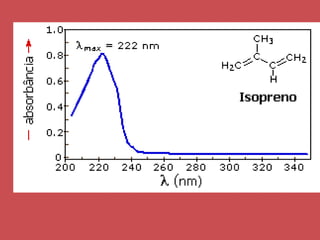
O documento descreve os principais parâmetros da radiação eletromagnética, incluindo sua natureza ondulatória e corpuscular. Detalha características como período, frequência, comprimento de onda e espectro eletromagnético, além de descrever como a radiação interage com a matéria através de absorção.