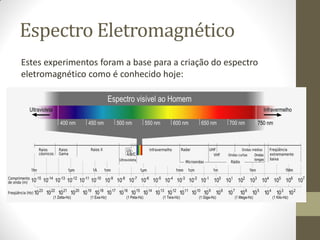
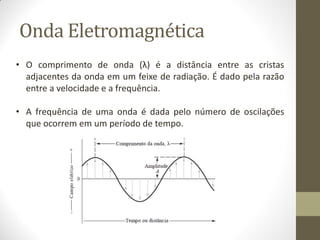
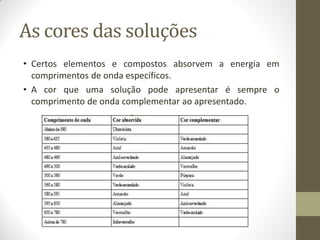
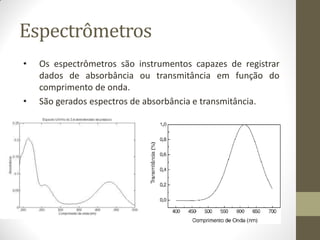
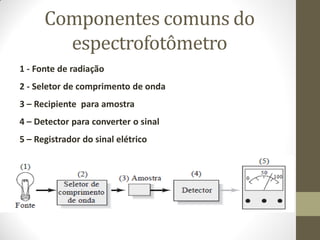
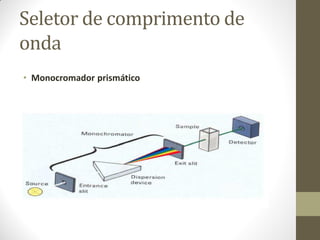
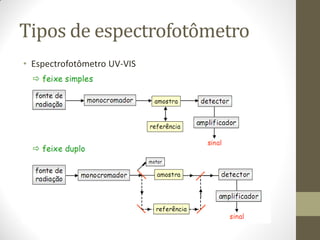
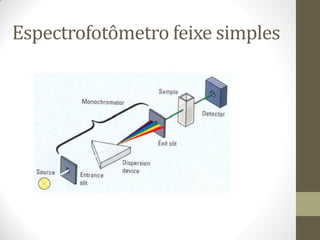
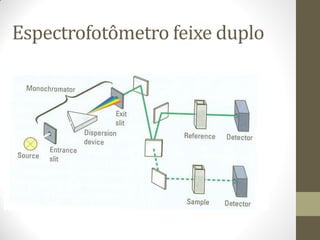
Este documento descreve os princípios da espectroscopia na região UV-VIS. Explica que esta técnica analisa amostras para determinar sua concentração ou componentes, baseando-se na absorção de energia por transições eletrônicas entre orbitais moleculares. Também descreve os componentes do espectrofotômetro e a lei de Lambert-Beer, que relaciona a absorção à concentração da amostra.