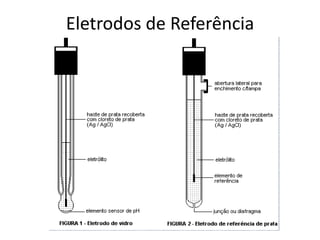
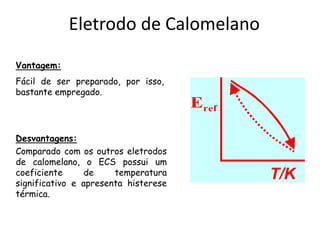
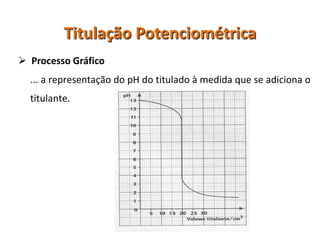
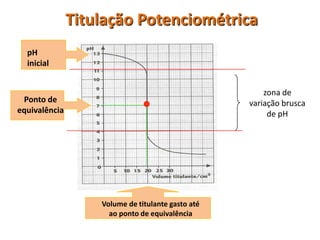
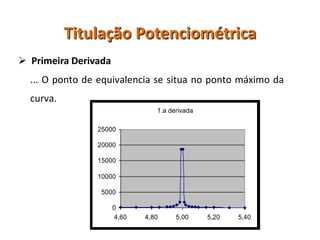
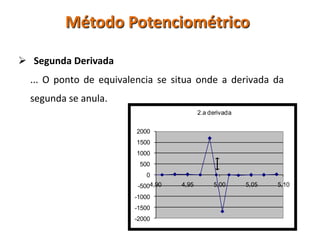
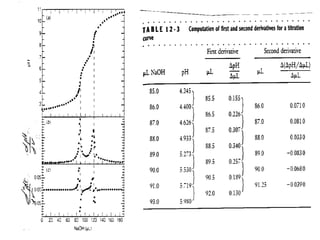
O documento discute diferentes eletrodos de referência ideais e seus potenciais, incluindo eletrodos de calomelano e prata/cloreto de prata. Também aborda titulações potenciométricas e seus princípios, além de aplicações como a determinação de alumínio tóxico em raízes de trigo e cobre em cachaça.