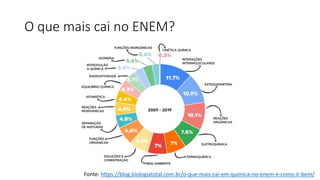
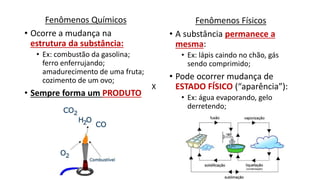
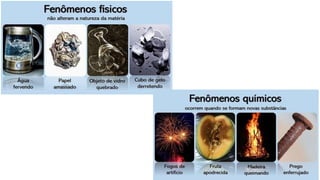
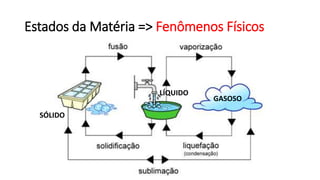
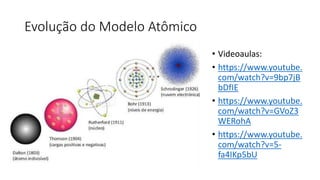
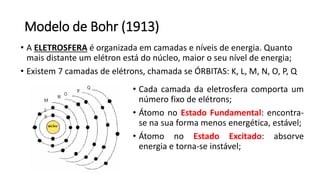
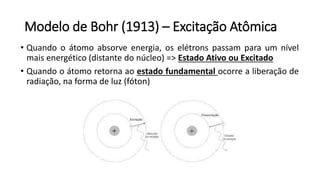
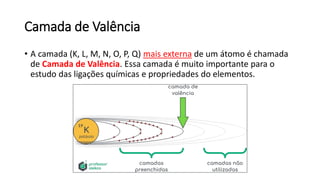
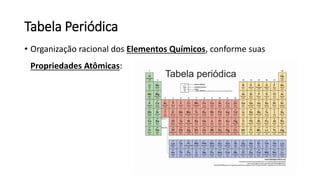
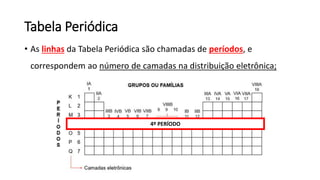
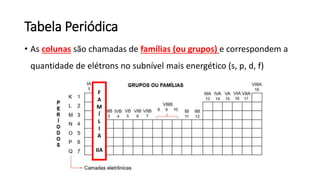
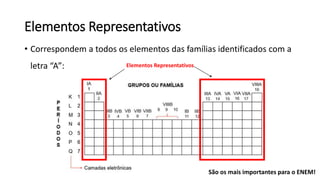
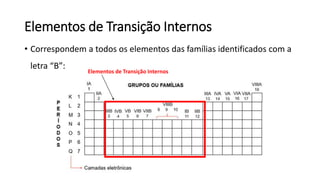
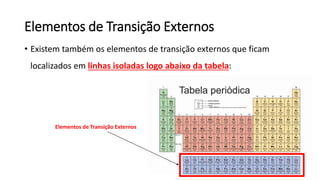
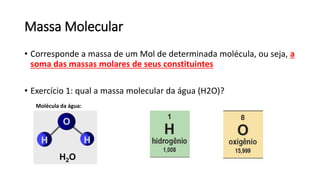
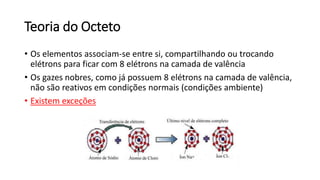
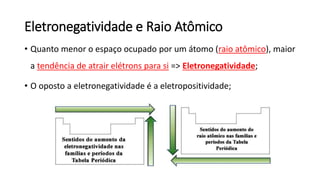
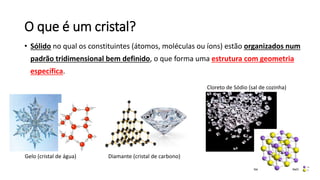
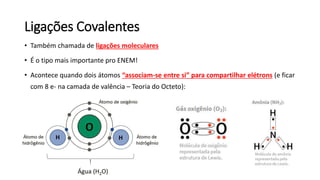
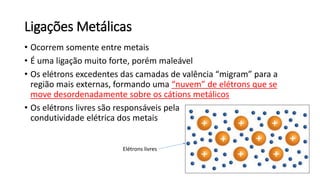
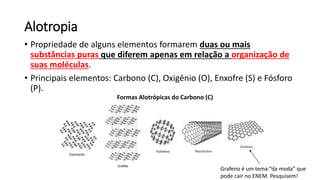
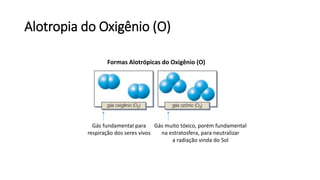
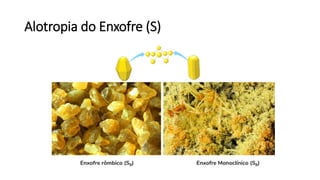
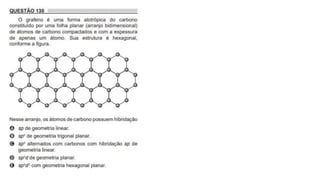
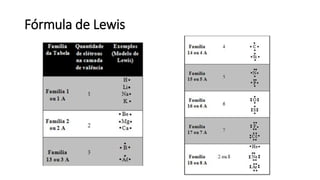
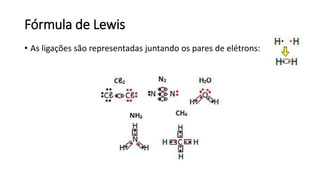
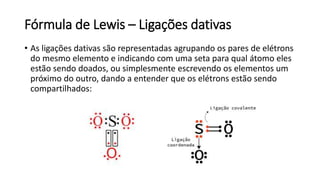
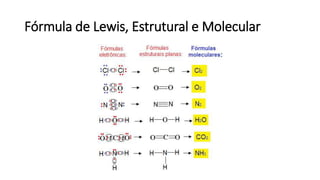
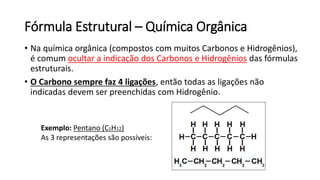
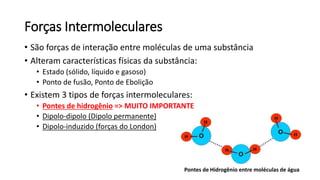
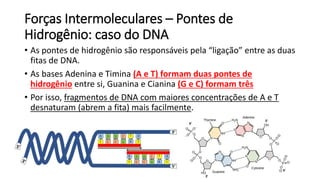
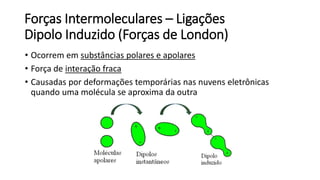
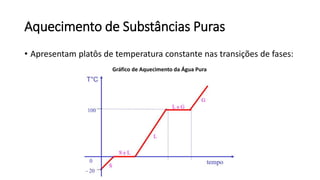
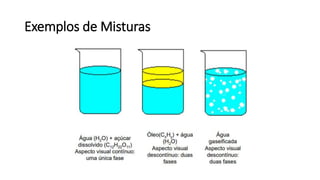
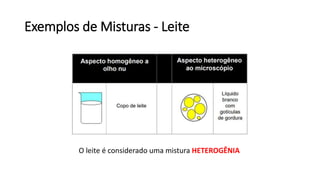
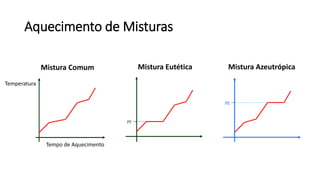
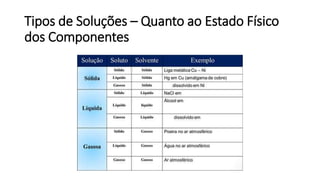
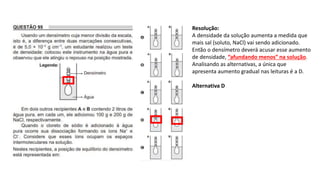
O documento resume os principais tópicos de Química Geral que podem cair no ENEM, incluindo: 1) definição de química e diferença entre fenômenos físicos e químicos; 2) estados da matéria; 3) teoria atômica e estrutura atômica; 4) tabela periódica e propriedades periódicas. Além disso, aborda tópicos como ligações químicas, equações químicas e soluções.