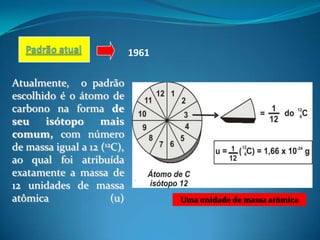
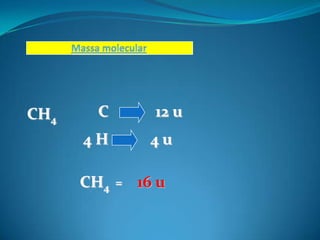
1) O documento discute massa atômica e molecular, com foco em unidades de medida e escolha do carbono-12 como padrão.
2) Vários elementos foram usados como padrões ao longo do tempo, incluindo hidrogênio e oxigênio, até se adotar o carbono-12.
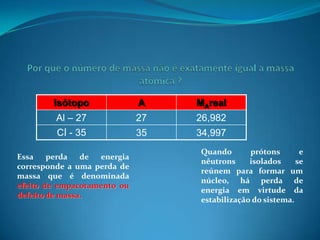
3) A massa atômica leva em conta isótopos e defeitos de massa na formação do núcleo atômico.