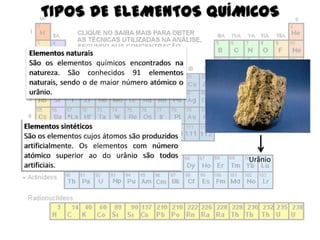
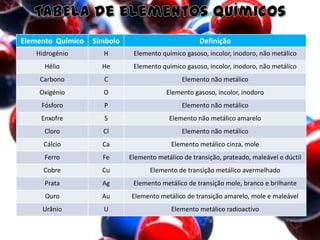
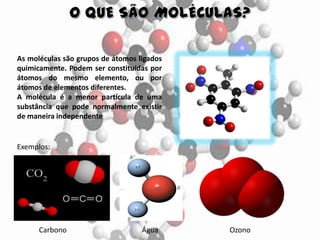
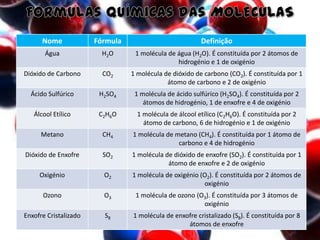
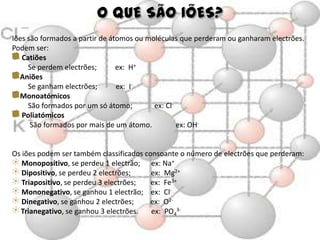
O documento aborda elementos químicos, suas definições, tipos e exemplos, bem como a formação de moléculas e íons. Detalha a tabela de elementos químicos, mencionando o estado físico e características de diversos elementos. Inclui exemplos de moléculas com suas respectivas fórmulas e composições atômicas.