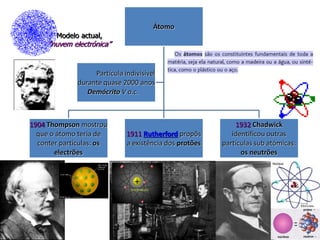
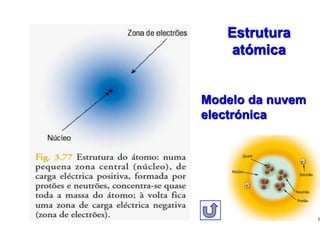
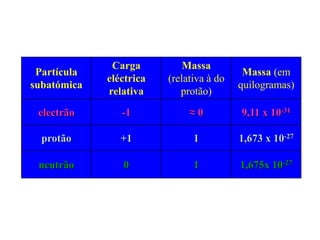
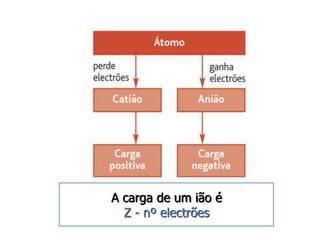
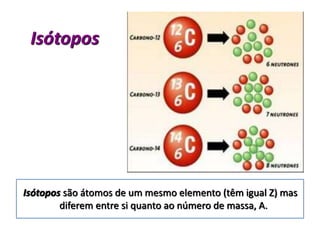
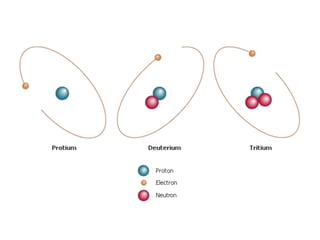
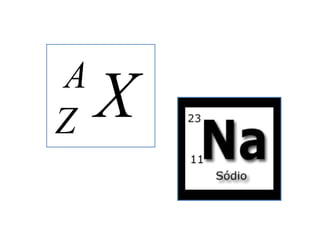1) O documento descreve a estrutura atômica, incluindo as partículas subatômicas (elétrons, prótons e nêutrons) e o modelo atômico atual de nuvem eletrônica.
2) Foi Ernest Rutherford quem realizou experimentos em 1911 que levaram à conclusão de que o átomo é constituído por um núcleo positivo circundado por uma região mais extensa contendo os elétrons.
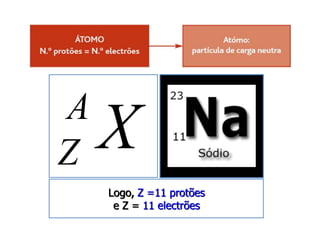
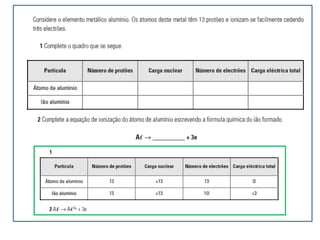
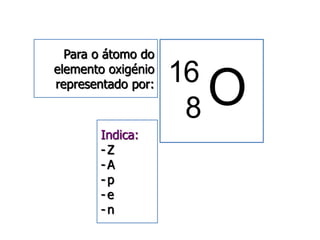
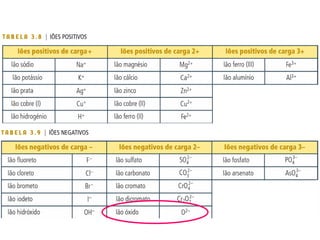
3) O número atômico representa o número de prótons no núcleo,