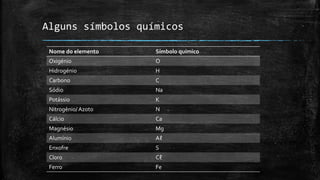
1) O documento descreve a constituição dos átomos, incluindo protões, neutrões e eletrões, e como os diferentes tipos de átomos são representados por símbolos químicos.
2) É explicado que as moléculas são grupos de átomos ligados e que as fórmulas químicas indicam qualitativamente e quantitativamente a composição das moléculas.
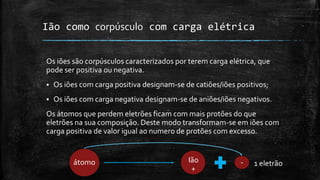
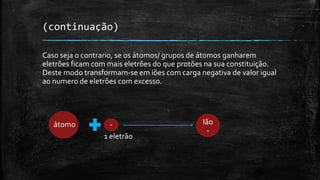
3) São descritos iões como corpúsculos com carga elétrica e como as fórmulas químicas dos sais indicam a propor