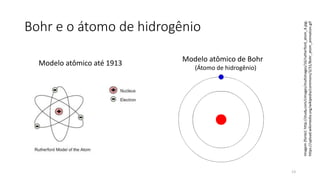
1) O documento descreve a evolução da teoria atômica desde Democritus até os modelos atômicos modernos, incluindo as descobertas de Thomson, Rutherford, Bohr, de Broglie, Schrödinger e Heisenberg.
2) Foi proposto que a matéria é constituída de átomos indivisíveis, e posteriormente descoberto que os átomos possuem estrutura interna com núcleo e elétrons.
3) Os modelos atômicos evoluíram da concepção de átomos



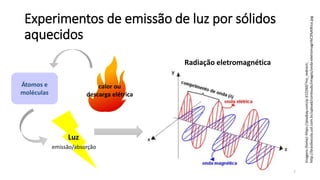
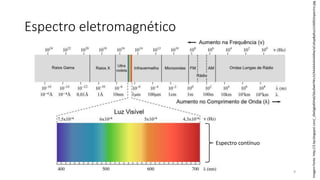
![Radiação eletromagnética
ν = Frequência [Hz = s-1 (ciclos por segundo)]
λ = Comprimento de onda (nm)
Velocidade da luz: c = 3,00 x 108 m/s
𝑐 = νλ
Imagem(fonte):http://images.melhortvlcd.com.br/images/2011/07/frequencia1.jpg
8](https://image.slidesharecdn.com/tomos1-170524221227/85/Atomos-e-o-mundo-quantico-8-320.jpg)