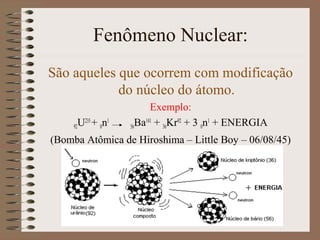
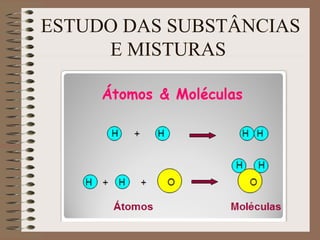
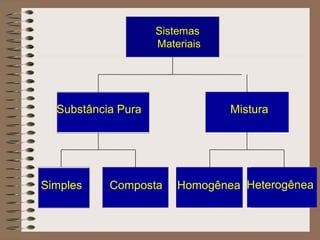
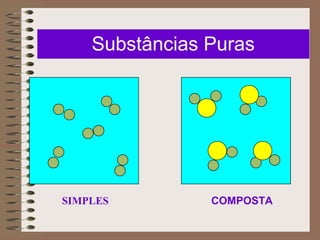
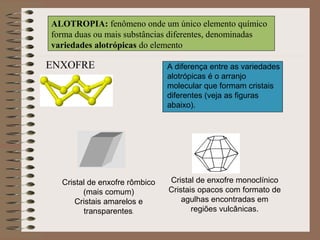
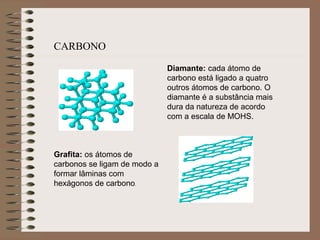
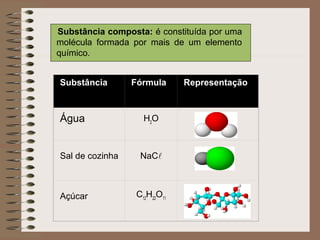
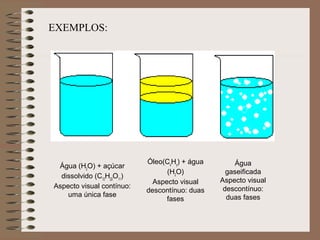
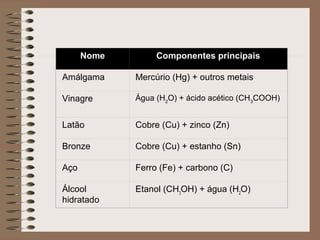
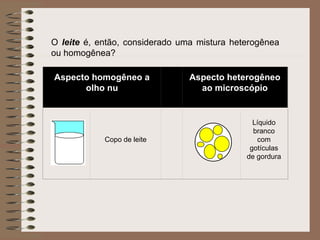
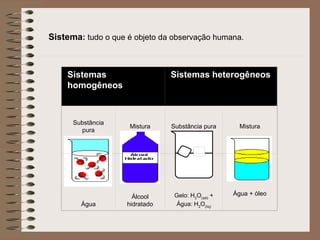
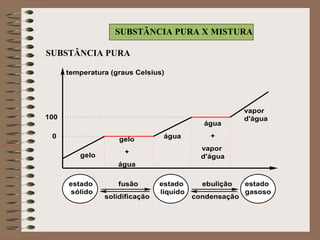
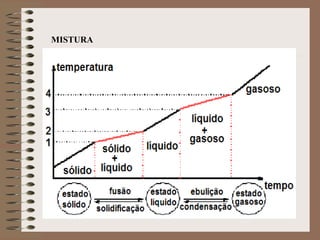
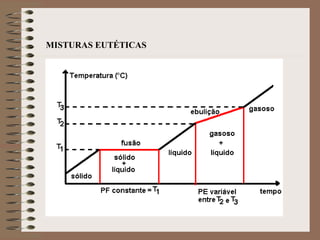
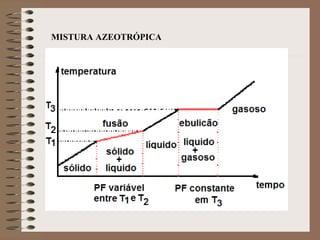
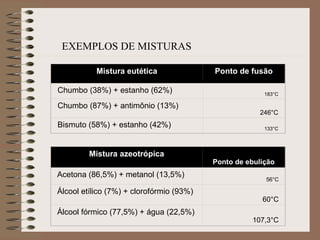
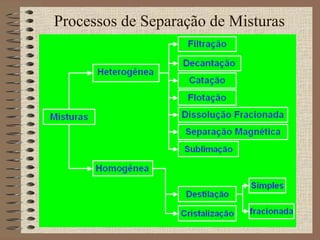
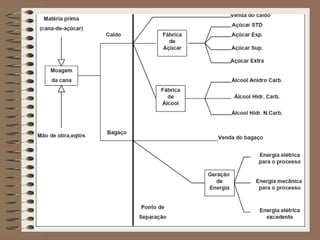
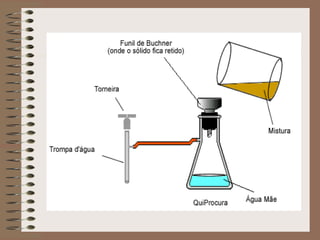
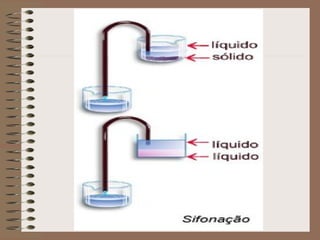
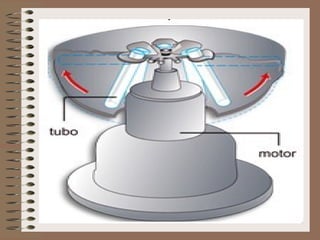
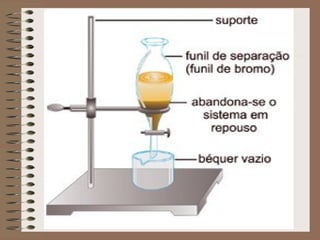
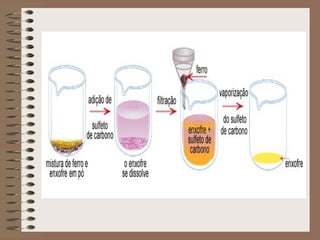
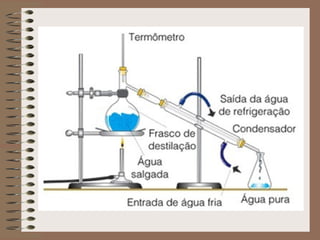
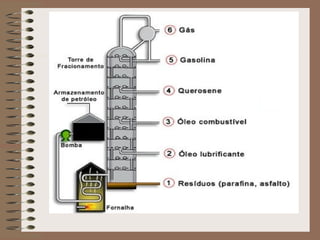
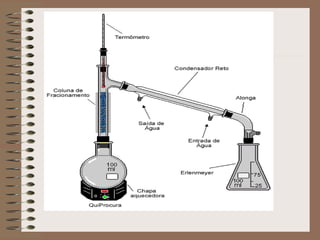
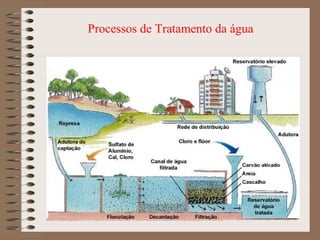
O documento descreve diferentes tipos de transformações da matéria, incluindo fenômenos físicos, químicos e nucleares. Ele também explica conceitos como substâncias puras, misturas homogêneas e heterogêneas, e métodos de separação de misturas como filtração, decantação e destilação.