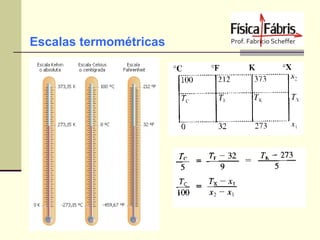
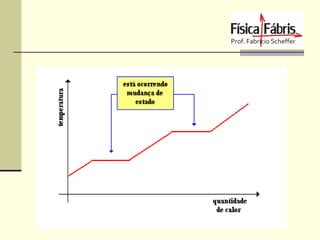
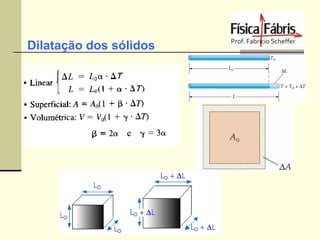
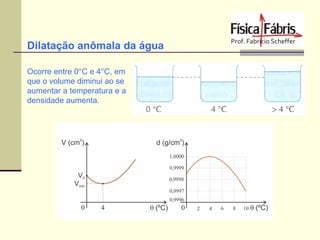
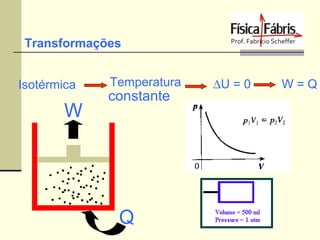
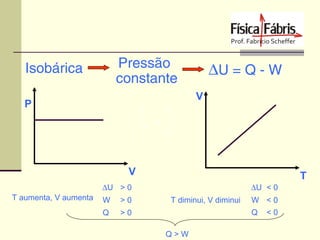
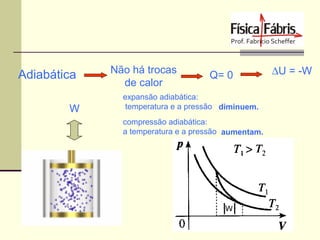
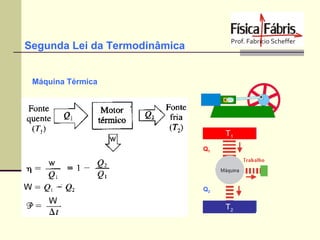
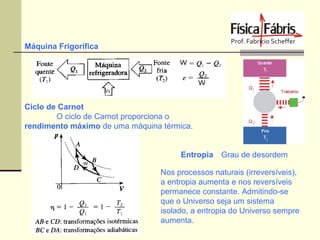
O documento discute os principais conceitos de termometria, calorimetria, transmissão de calor, gases, termodinâmica e a segunda lei da termodinâmica. Inclui definições de temperatura, escalas termométricas, quantidade de calor sensível e latente, tipos de transmissão de calor, lei dos gases ideais, transformações termodinâmicas e o conceito de entropia.