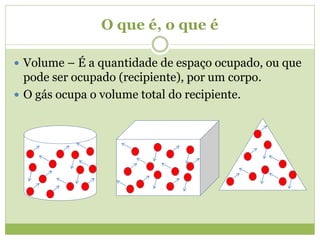
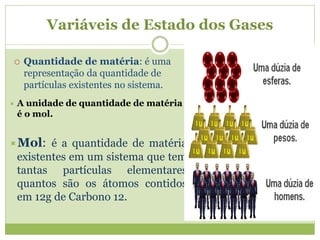
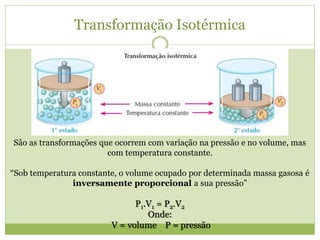
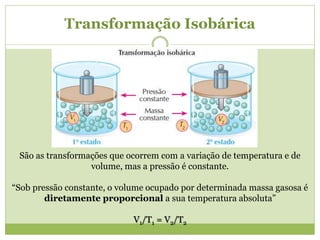
Este documento discute as propriedades e transformações dos gases, incluindo:
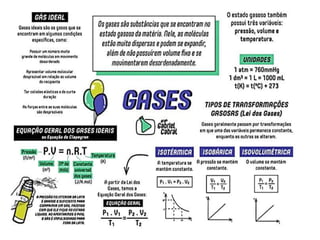
1) As variáveis de estado dos gases (volume, pressão, temperatura e quantidade de matéria) e suas unidades de medida.
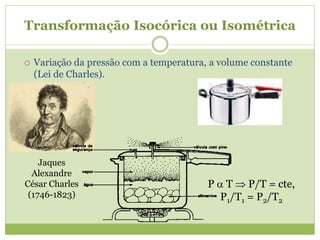
2) As três transformações básicas dos gases (isotérmica, isobárica e isocórica) e suas equações.
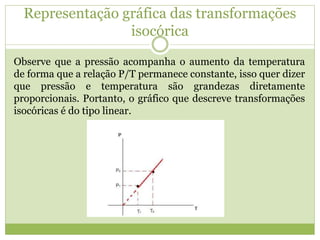
3) A representação gráfica das transformações gasosas.
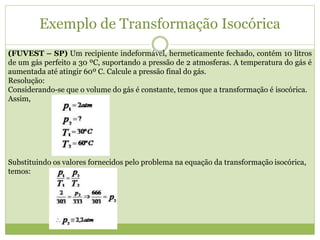
4) A equação geral dos gases e exemplos de cálculos envolvendo as propriedades dos gases.