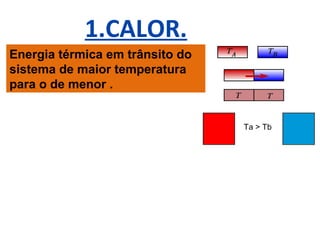
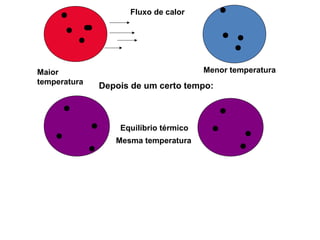
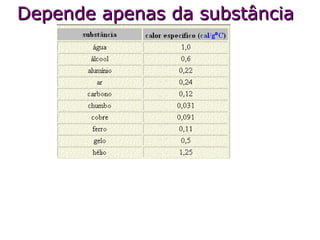
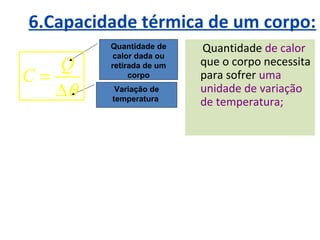
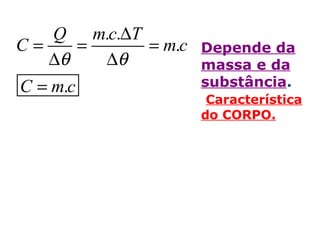
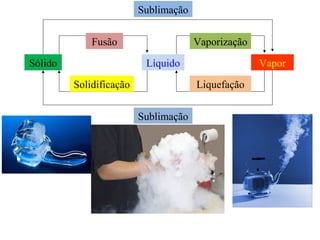
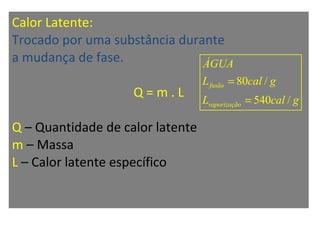
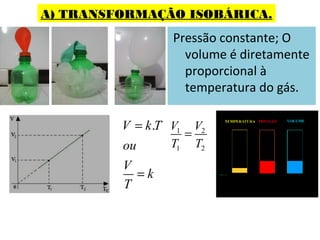
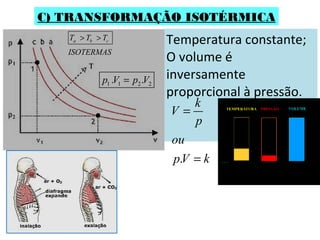
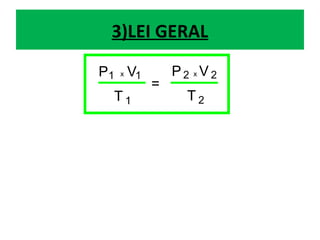
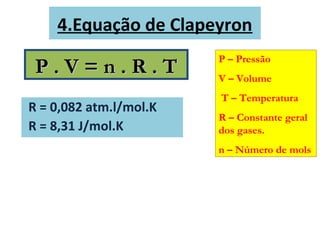
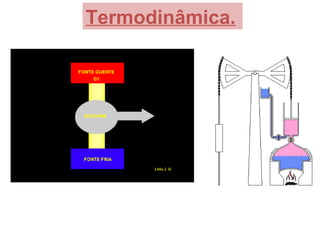
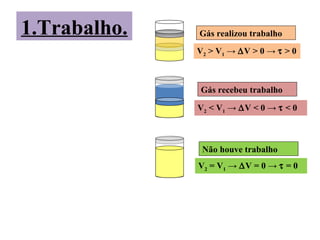
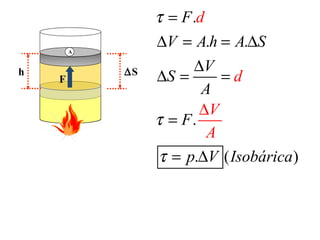
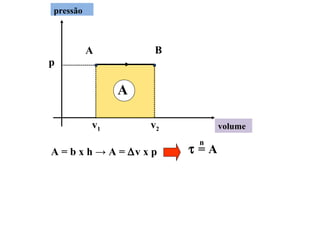
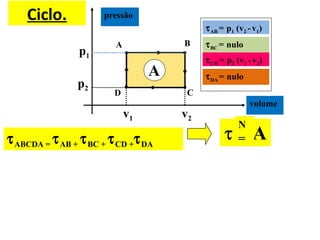
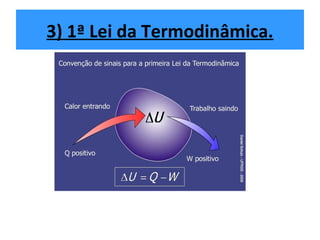
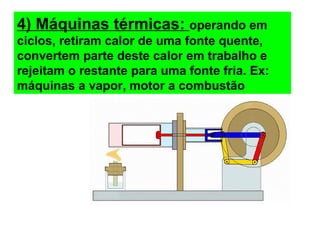
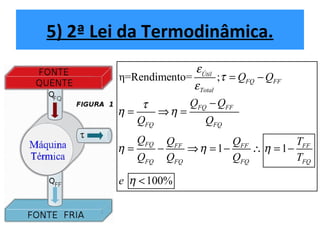
O documento descreve os principais conceitos de calorimetria e termodinâmica, incluindo: 1) a transferência de energia térmica entre sistemas de diferentes temperaturas; 2) unidades de medição de calor e temperatura; 3) equações que relacionam quantidade de calor, massa, calor específico e variação de temperatura.