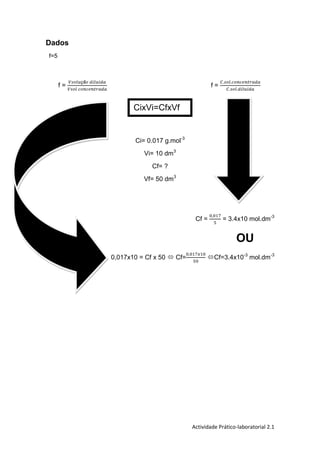
O documento descreve a preparação e diluição de soluções aquosas de sulfato de cobre pentahidratado, destacando o objetivo de preparar 100 cm3 de uma solução a 0,017 mol/dm3. O procedimento inclui a pesagem do soluto, dissolução, e diluição, com observações sobre as cores das soluções resultantes. Ao final, a conclusão ressalta a experiência adquirida e a eficácia do trabalho em grupo.