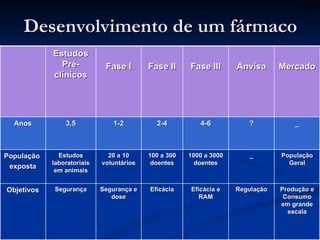
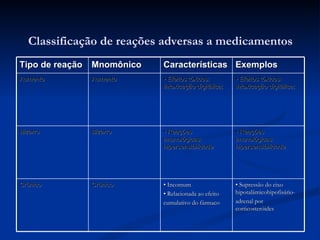
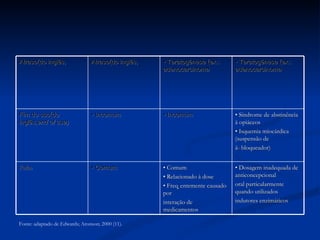
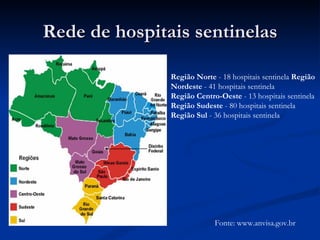
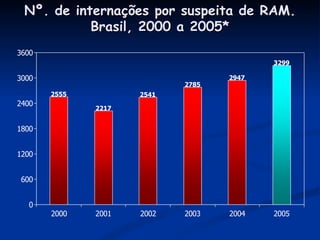
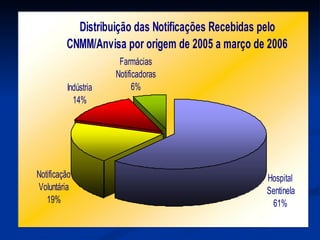
O documento discute conceitos gerais de segurança de medicamentos, incluindo efeitos colaterais, eventos adversos e reações adversas. Também aborda o histórico da regulamentação de medicamentos nos EUA e Brasil, destacando eventos como a talidomida. Finalmente, descreve métodos de monitoramento de reações adversas como a farmacovigilância e redes de hospitais sentinelas.