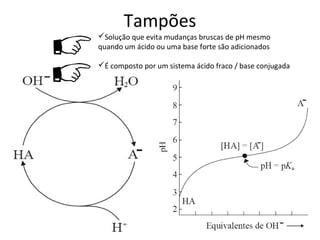
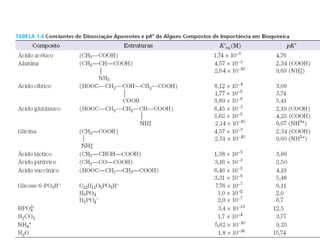
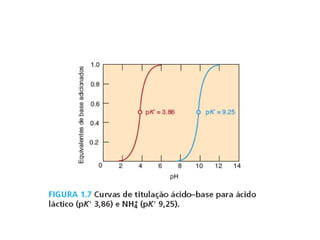
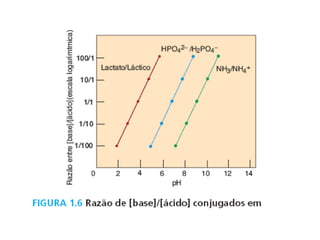
O documento discute pH e tampões, definindo conceitos como:
1) Autoionização da água e a constante de dissociação da água (Kw);
2) Definição de pH como o logaritmo negativo da concentração de H+;
3) Relação entre [H+], [OH-], pH e pK e como isso define se uma solução é ácida, básica ou neutra.

![Auto-ionização da água
H20 H+ + OH-
[H+] [OH-] = 1,8 x 10-16
K = ________
[H20]](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-2-320.jpg)
![Conceito de Kw
Massa molar Densidade
[H ] [OH ]
+ -
da água da água
1,8 x 10 = ________
-16
(g/mol) (g/mL)
A [H20] é sempre
[H20] H–1 1 g/mL
= 55,5 mol/ L O – 16 1000 g/L
H2O – 18
[H+] [OH-] Reorganizando a
1,8 x 10-16 = ________ equação, temos: [H20] = ? mol/L
55,5 (mols por litro)
Calculando o
1,8 x 10-16 x 55,5 = [H+] [OH-] produto no 18 g – 1 mol
primeiro membro 1000 g (1 L) – x mol
da equação:
Kw = 1,0 x 10-14 = [H+] [OH-] X = 1000 / 18
X = 55,5 mol / L
O produto entre as
concentrações de H+
Kw = 10-14 = [H+] [OH-] e OH- é sempre igual
[H20] = 55,5 mol/L
a 10-14](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-3-320.jpg)
![Conceito de Kw
constante de dissociação da água
O produto entre as
Kw = 10-14 = [H+] [OH-]
c concentrações de H+
e OH- é sempre igual
a 10-14](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-4-320.jpg)
![Escala de pH
Para evitar a utilização de números muito pequenos e
de notação exponencial estabeleceu-se o uso do termo
p
Que significa “menos logaritmo de... ”
Ex.:
[H+] = 0,0000001 M = 1,0 x 10-7
log [H+] = -7
pH = -log[H+] = 7
pH, então, significa
“logaritmo negativo” da concentração de H+
OBS - É mais correto dizer “o simétrico do logaritmo da concentração de H+”](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-5-320.jpg)
![Definição de pH
pH é o “logaritmo negativo” da
concentração de H+
c
pH = -log[H ]+](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-6-320.jpg)
![Relações entre [H+], [OH-], pH e pOH
[H+] mol/L pH [OH-] mol/L pOH
1 (1 x 100) 0 1 x 10-14 14
OBSERVAÇÕES
1 x 10 -1 1 1 x 10-13
13
1 x 10-2 2 1 x 10-12 12 [H+] x [OH-] é sempre igual a 10-14
ácido
1 x 10-3 3 1 x 10-11 11
pH + pOH é sempre igual a 14
1 x 10-4 4 1 x 10-10 10
1 x 10-5 5 1 x 10-9 9 Em pH 7 a [H+] é igual a [OH-]
por isso esse valor é considerado
1 x 10-6 6 1 x 10-8 8
neutro
neutro 1 x 10-7 7 1 x 10-7 7
1 x 10-8 8 1 x 10-6 6 Em pH < 7 a [H+] é maior que a
[OH-] por isso esses valores é
1 x 10-9 9 1 x 10-5 5
considerados ácidos
básico
1 x 10-10 10 1 x 10-4 4
(ou alcalino) Em pH > 7 a [OH-] é maior que a
1 x 10-11 11 1 x 10-3 3
[H+] por isso esses valores é
1 x 10-12 12 1 x 10-2 2
considerados ácidos
1 x 10-13 13 1 x 10-1 1
1 x 10-14 14 1 (1 x 100) 0](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-7-320.jpg)
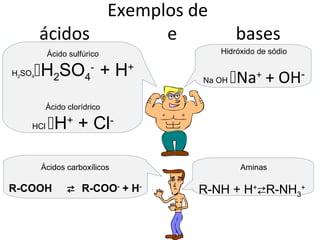
![Constante de
dissociação
com a
Conceito de Ka e pKa
concentração
de água Constante de dissociação
“embutida”
[CH3—COO-] [H+]
K = __________________
[CH3—COOH][H2O]Como a [H2O] é
praticamente constante e
igual a 55,5 mol/L.
[CH3—COO-] H+]
[
_______________ Podemos “embutir” na
Ka = constante K
[CH3—COOH] transformando-a em Ka
Para o ácido acético:
pKa = -logKa
Ka = 1,74 x 10-5
-log da
constante de pKa = -log (Ka)
dissociação
pKa = -log (1,74 x 10-5)](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-11-320.jpg)

![Equilíbrio químico
dissociação
Grau de
na dissociação de um ácido fraco
HAH+ + A-
HA Pouco dissociado
HA HA HA HA
HA HA H+ A-
HA [HA]>>[A-]
HA
HA HA HA HA
HA
HA HA HA H+ A- [A-] /[HA]<<1
HA HA HA
H+ A- H+ A- H+ A- Semi dissociado
HA HA HA
HA H+ A - H+ A- H+ A-
HA [HA]=[A-]
HA HA H+ A- H+ A-
HA H+ A-
HA HA HA [A-] /[HA]=1
H+ A- H+ A-
H+ A- H+ A- H+ A - H+ A-
Muito dissociado
H +
A- H+ A- H+ A- H+ A-
HA H+ A- H+ A- H+ A- [HA]>>[A-]
HA H+ A- H+ A- H+ A- H+ A-
H+ A - H+ H+ A- [A-] /[HA]>>1
A- H +
A - H+ A-](https://image.slidesharecdn.com/003ph20112-121110054332-phpapp01/85/003-ph-2011_2-13-320.jpg)