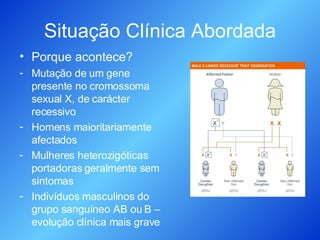
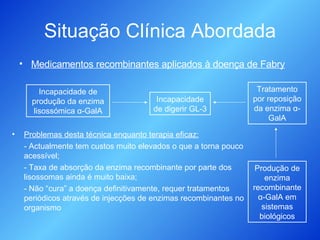
O documento discute medicamentos recombinantes, especificamente no tratamento da doença de Fabry. Descreve como a enzima alfa-galactosidase A é produzida através da engenharia genética em leveduras para substituir a enzima deficiente nesses pacientes, permitindo a digestão do glicoesfingolípido GL-3 que de outra forma se acumularia. O processo de purificação da enzima recombinante é detalhado.