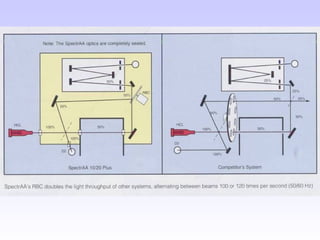
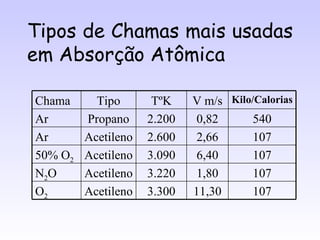
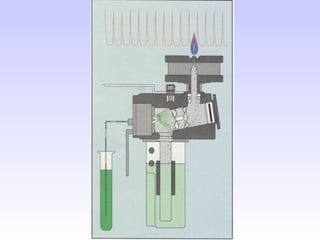
O documento discute as fontes de radiação utilizadas em espectrofotometria de absorção atômica, incluindo considerações sobre a radiação ideal, fontes contínuas e de raias espectrais, e lâmpadas de cátodo oco. Também aborda sistemas de nebulização, queimadores, interferências e métodos alternativos de atomização sem chama, como atomizadores eletrotérmicos e geração de hidretos.