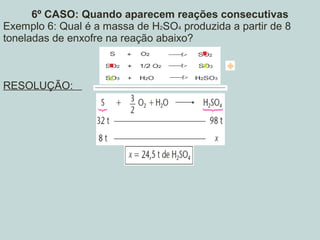
Este documento discute os princípios da estequiometria, incluindo: 1) Leis da conservação de massa e proporções constantes; 2) Equações químicas e balanceamento; 3) Cálculos estequiométricos usando massa, volume ou mols de reagentes e produtos. Exemplos demonstram como resolver problemas envolvendo reações químicas quantitativas.