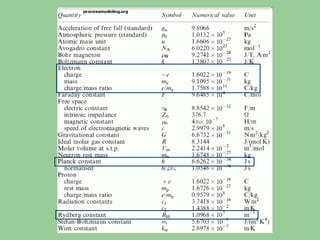
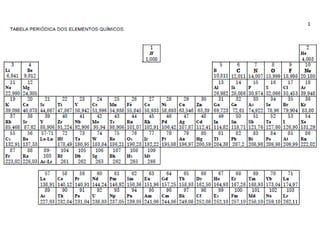
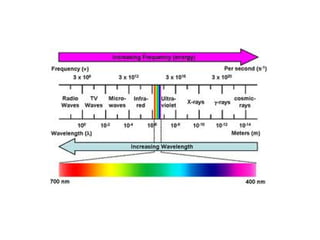
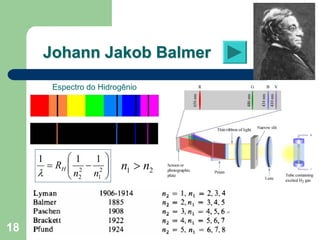
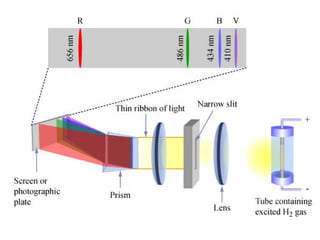
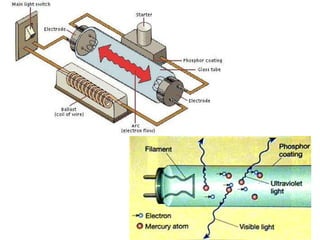
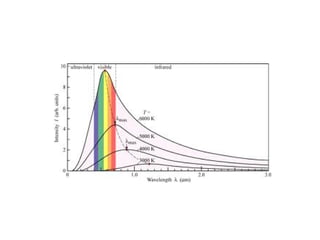
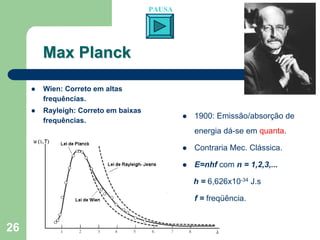
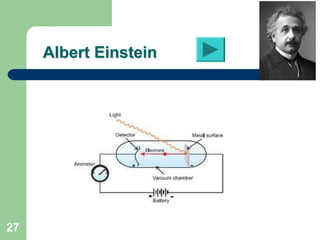
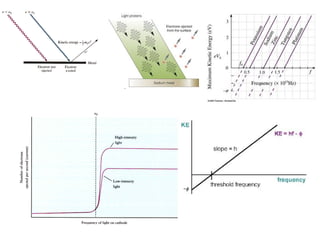
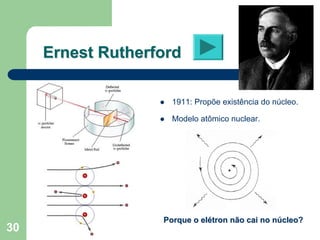
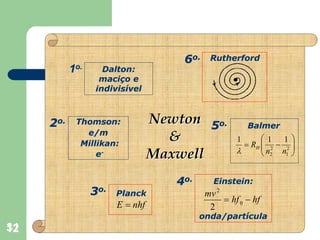
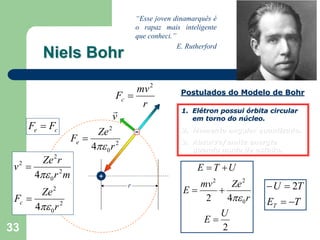
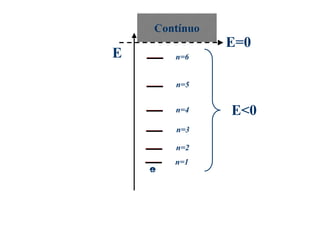
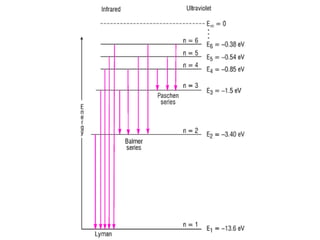
O documento apresenta os objetivos e programa de um curso de Química Geral e Tecnológica, abordando tópicos como estrutura atômica, configuração eletrônica e ligações químicas. A estrutura atômica é discutida no contexto da Química, desde a escala submicroscópica até a macroscópica. Informações sobre massa de partículas subatômicas e constantes físicas também são fornecidas.