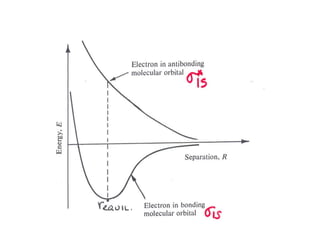
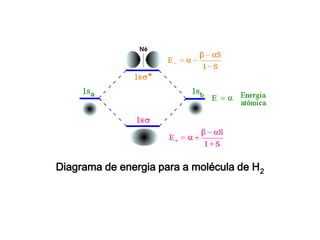
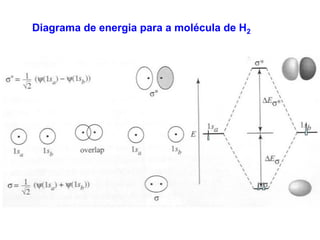
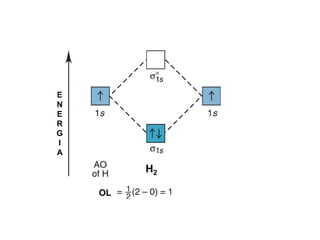
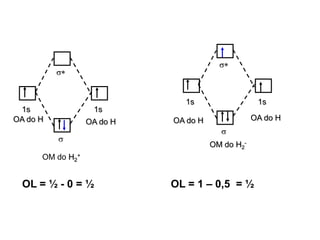
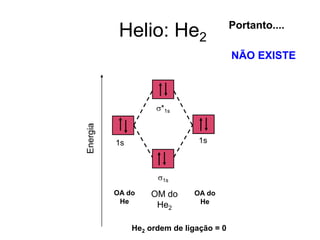
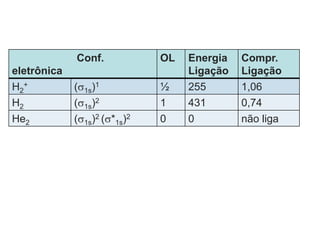
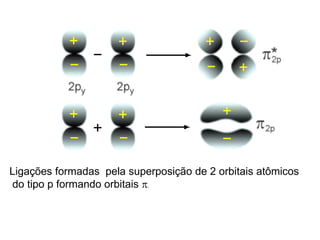
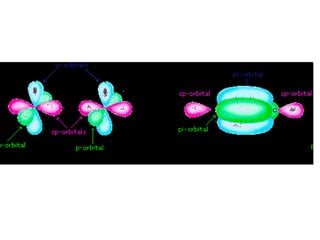
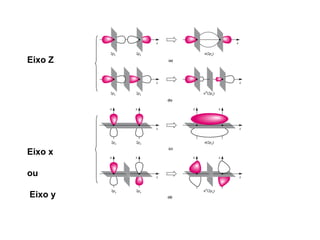
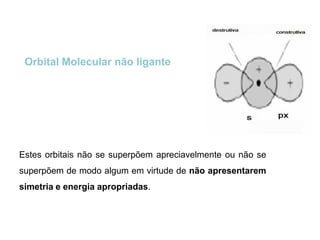
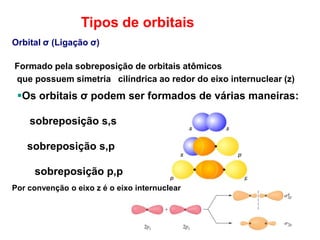
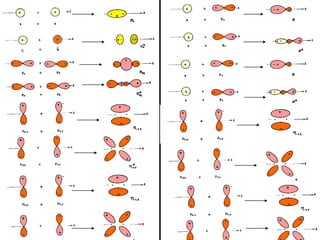
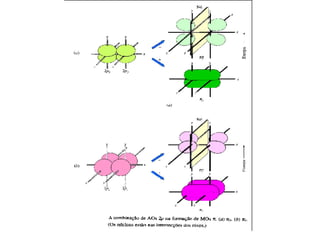
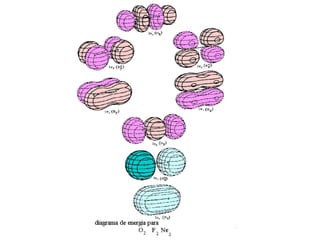
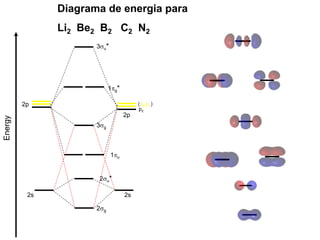
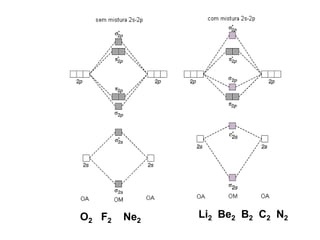
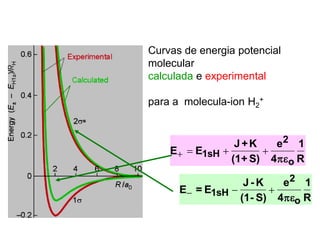
O documento discute a teoria dos orbitais moleculares para explicar as propriedades de moléculas diatômicas. Apresenta como os orbitais atômicos podem se combinar de forma construtiva ou destrutiva para formar orbitais moleculares ligantes ou antiligantes. Explica como calcular a energia destes novos orbitais e predizer a ordem de ligação e a energia de ligação de moléculas como H2 e He2.





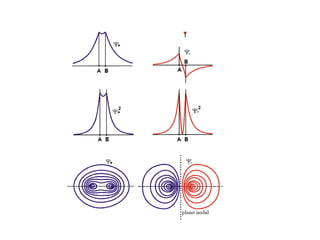
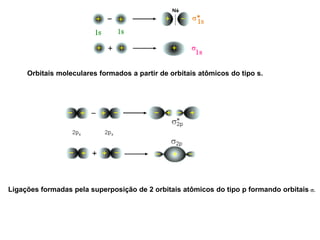
![MolecularOrbital
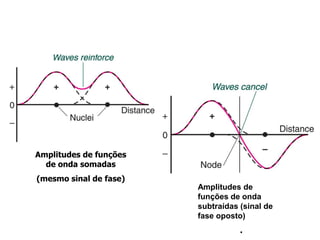
H2
representação da interferência
construtiva que ocorre quando
dois orbitais H 1s se superpõe e
formam um orbital molecular
(1)
1
2(1 S)
[A(1) B(1)]](https://image.slidesharecdn.com/aula2ligacaoquim-130912082354-phpapp02/85/Aula2-ligacaoquim-12-320.jpg)
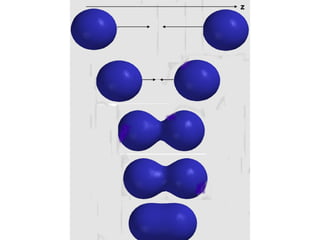
![H2
representação da interferência
destrutiva que ocorre quando
dois orbitais H 1s se superpõe e
formam um orbital molecular
(1)
1
2(1 S)
[A(1) B(1)] Função de onda atômica, estado antiligante](https://image.slidesharecdn.com/aula2ligacaoquim-130912082354-phpapp02/85/Aula2-ligacaoquim-13-320.jpg)
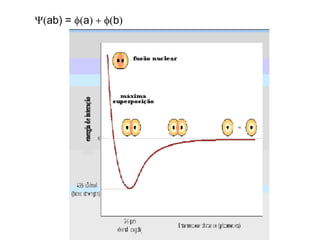
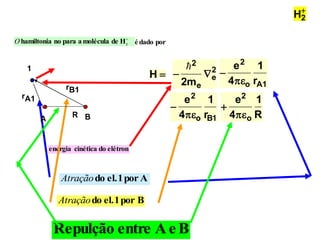
![Em termos de energia
Y(ab) = f(a) f(b)
Calcular para as duas situações
Usando:
Y(ab) = f(a) [f(b)]](https://image.slidesharecdn.com/aula2ligacaoquim-130912082354-phpapp02/85/Aula2-ligacaoquim-14-320.jpg)