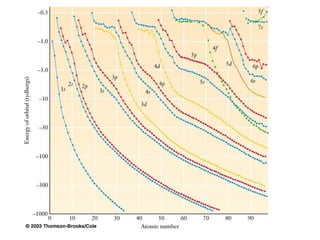
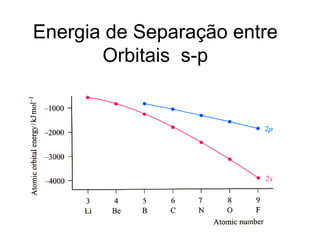
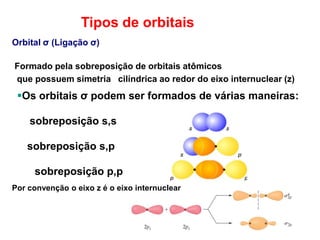
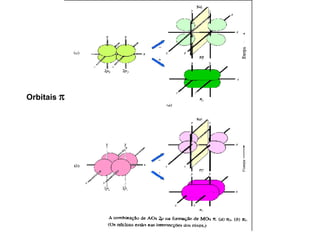
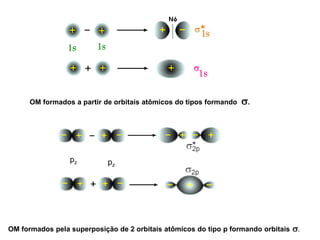
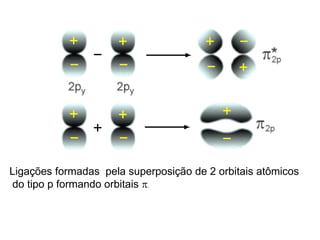
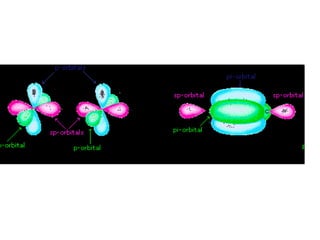
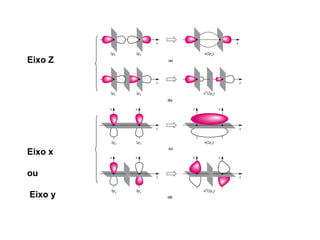
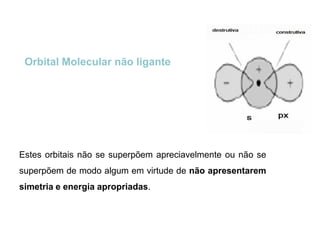
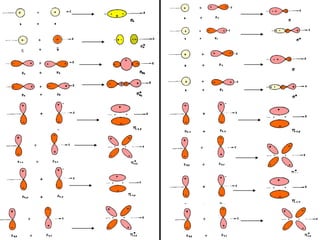
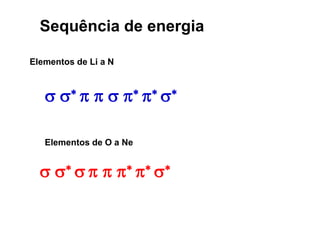
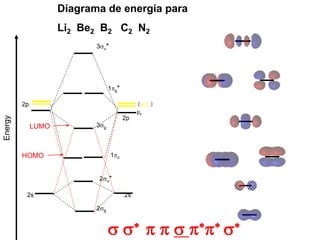
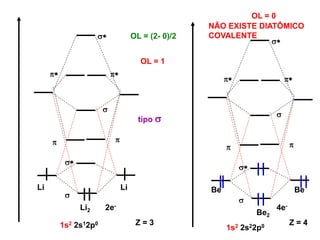
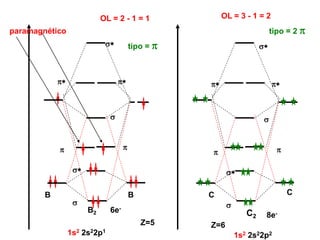
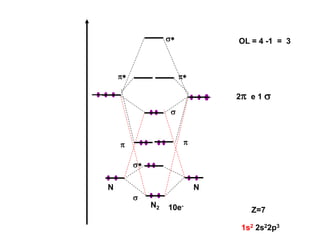
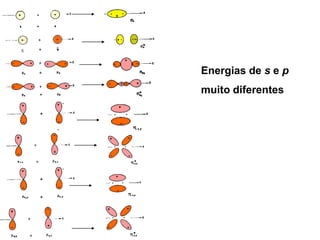
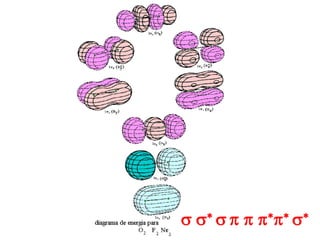
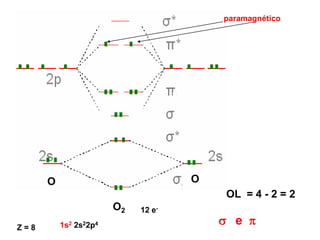
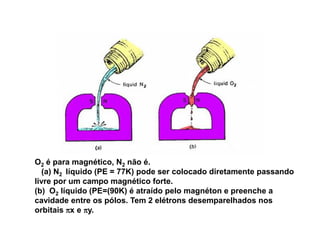
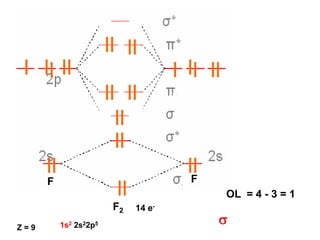
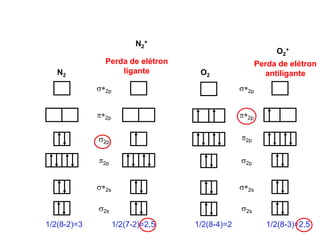
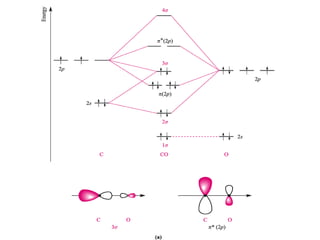
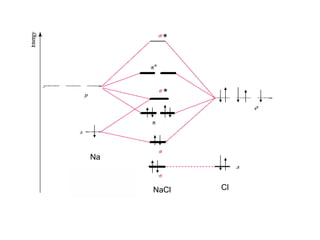
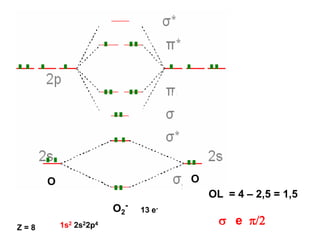
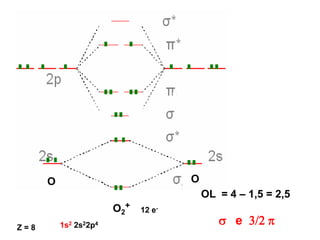
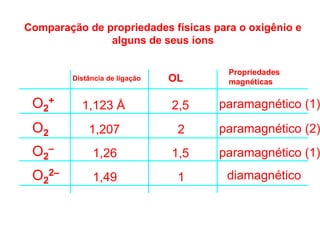
O documento discute os tipos de orbitais moleculares formados pela sobreposição de orbitais atômicos, incluindo orbitais σ e π. Exemplifica a formação de orbitais moleculares para diversas moléculas diatômicas como Li2, Be2, B2, C2, N2, O2 e F2 e discute suas energias de ligação e propriedades magnéticas.