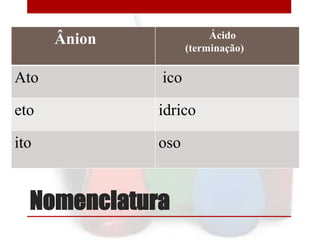
O documento fornece informações sobre ácidos, incluindo suas propriedades, classificações e exemplos. Define ácidos como compostos que liberam íons hidrogênio quando dissolvidos em água. Discute como ácidos podem ser classificados de acordo com o número de hidrogênios ionizáveis, elementos na molécula, presença de oxigênio e volatilidade. Também lista alguns dos ácidos mais importantes.