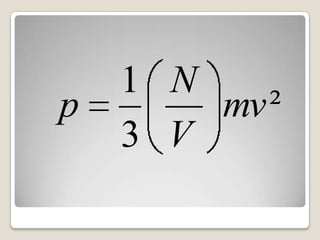O documento descreve o modelo cinético de um gás, explicando que um gás é constituído de partículas (moléculas) em movimento constante devido a colisões elásticas, e que a pressão exercida pelo gás nas paredes do recipiente é resultado das colisões das moléculas. A expressão matemática para a pressão de um gás é derivada usando esse modelo cinético, relacionando a pressão com o número de moléculas, volume, massa e velocidade das moléculas. Essa expressão permite interpretar a