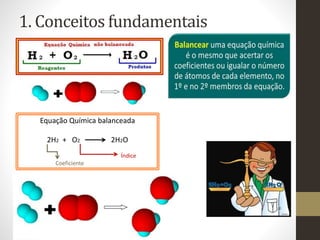
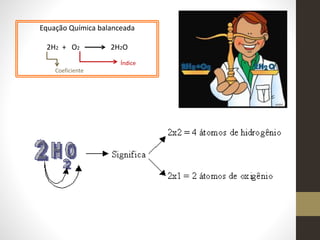
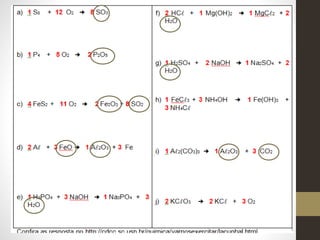
1) O documento discute conceitos fundamentais de equações químicas balanceadas e fornece exemplos de como balancear equações.
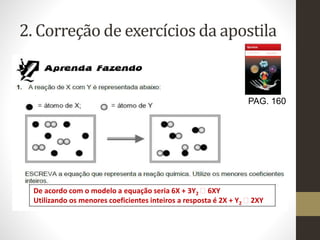
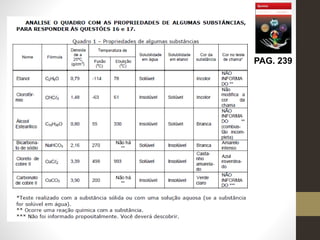
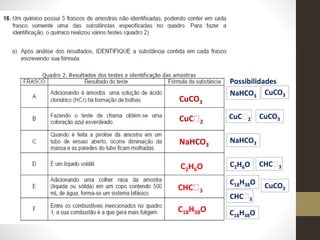
2) Inclui exercícios de equações químicas tirados de uma apostila e explica como resolvê-los.
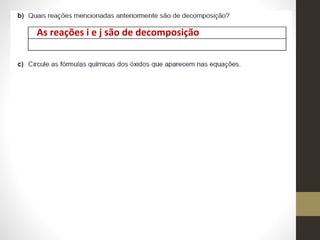
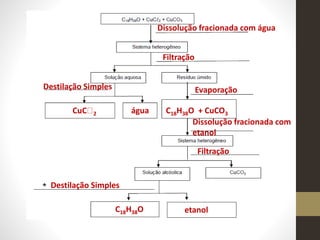
3) Apresenta possíveis reações químicas para diferentes combinações de substâncias químicas.